Цель урока. Дать понятие о гидролизе
солей; научить составлять полные и сокращенные ионные уравнения реакций
гидролиза солей; сформировать умение предсказывать среду растворов
различных солей.
Оборудование. Дистиллированная вода,
оксид кальция, карбид кальция. На столах учащихся и демонстрационном
столе: растворы хлорида натрия, нитрата цинка, карбоната натрия, хлорид
железа (III.), лакмус, фенолфталеин, метиловый оранжевый, стаканы и
цилиндры (для демонстрации опытов), штатив с пробирками, спиртовка.
Кодоскоп.
ХОД УРОКА
I. На доске записать тему урока, разъяснить задачи и содержание урока.
II. Подготовка к восприятию нового материала.
Фронтальная беседа – опрос.
- Что определяет свойства растворов кислот?
- Как определяется наличие катионов водорода в растворе?
- Чем отличаются сильные кислоты от слабых? Привести примеры тех и других.
- В молекулах, каких кислот – сильных или слабых – водород связан прочнее?
- Дать определение основаниям.
- Как обнаруживается наличие гидроксид-ионов в растворе?
- Почему одни основания относятся к сильным электролитам, а другие – к слабым?
Привести примеры.
- В воде находятся катионы водорода и гидроксид-ионы. Почему она не изменяет окраски индикаторов подобно кислотам и щелочам?
Уяснив, что нейтральная среда растворов характеризуется
одинаковой концентрацией частиц-носителей кислотных и щелочных свойств,
записывают:

Затем конкретизируют сведения о солях:
- Можно считать, что соли – результат взаимодействия, в общем,
противоположных по свойствам веществ – кислоты и основания. Какими
кислотами и основаниями образованы следующие соли:
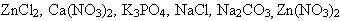 ? Укажите силу кислоты и основания. ? Укажите силу кислоты и основания. - В зависимости от силы основания или кислоты, из которых
образовались соли, их можно разделить на 4 типа:
- соли, образованные катионами сильного основания и анионами сильной кислоты;
- соли, образованные катионами сильного основания и анионами слабой кислоты;
- соли, образованные катионами слабого основания и анионами сильной кислоты;
- соли, образованные катионами слабого основания и анионами слабой кислоты.
Типы солей написаны на кодопленке. После названия каждого типа соли
оставляют место, которое будет заполнено примерами и выводами из
эксперимента.
III. Изучение нового материала.
Отправным моментом содержания темы, является этимология понятия
«гидролиз». Подчеркивают, что особенность воды проявляется и в свойстве
ее молекул взаимодействовать со многими веществами.
Демонстрация гидролиза карбида кальция (в пробирке) и оксида кальция (в химическом стакане). Опыты подтверждают сказанное.
Гидролиз рассмотренных веществ можно выразить схемами:
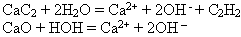
Гидролизу подвергаются соединения различных классов. Рассмотрим один из распространенных случаев – гидролиз солей.
Вопрос классу:
- Какую реакцию имеют растворы солей?
Предполагаемый ответ – нейтральную.
Правильность выдвинутой гипотезы проверяем экспериментально. В три пробирки наливают растворы солей 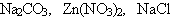 и испытывают их индикатором. Результаты опытов заносятся в таблицу: и испытывают их индикатором. Результаты опытов заносятся в таблицу:
Формула соли
|
Окраска лакмуса
|
Среда
|
Какими по силе основанием и кислотой образована соль
|
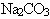
|
Синяя |
Щелочная |
Сильное основание, слабая кислота |
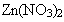
|
Красная |
Кислая |
Слабое основание, сильная кислота |
NaCl |
Фиолетовая |
Нейтральная |
Сильное основание, сильная кислота |
Как видно из таблицы, результаты опытов позволяют создать проблемную ситуацию. Приступают к решению проблемы.
Разбирается состав первой системы (раствор карбоната натрия). Соль – сильный электролит, в растворе содержится в виде ионов:
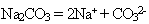
Вода очень слабый электролит. Могут ли Na+ взаимодействовать с молекулами воды? Допустим,
Но при этом образуется сильный электролит. Гипотеза не подтверждается.
Могут ли ионы 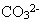 реагировать с водой? Тогда реагировать с водой? Тогда
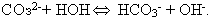
Гипотеза имеет смысл, так как при этом образуется очень мало диссоциирующий ион 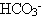 - прочно удерживающий протон. - прочно удерживающий протон.
Может ли гидролиз продолжаться дальше? В направлении
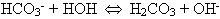
этот факт маловероятен, потому что увеличение концентрации
гидроксид-ионов неминуемо приведет к взаимодействию с образовавшейся
кислотой (принцип Ле Шателъе). Следовательно, в системе
устанавливается динамическое равновесие:
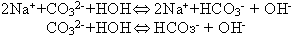
В тетрадях учащиеся записывают уравнение гидролиза:
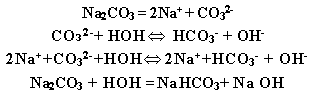
Почему среда данной системы стала щелочной? Из уравнений реакции
видно, что внесение в нейтральную среду анионов слабого электролита
вызвало сдвиг равновесия диссоциации воды в сторону образования
гидроксид-ионов.
Какие соли будут вести себя в водном растворе подобным образом?
Делают вывод: соли, образованные катионом
сильного основания и анионом слабой кислоты, подвергаются гидролизу,
так как анионы слабой кислоты, связывая ион водорода, вызывают сдвиг
равновесия воды в сторону образования гидроксид-ионов, от которых система приобретает щелочную среду, т. е. 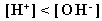 . .
Разбирается состав второй системы (раствор нитрата цинка). Соль –
сильный электролит, в растворе содержится в виде ионов:
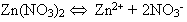
Вода очень слабый электролит и находится в виде молекул. Могут ли анионы 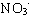 взаимодействовать с молекулами воды? Допустим взаимодействовать с молекулами воды? Допустим
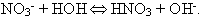
Но эта гипотеза лишена смысла, так как сильный электролит не может в растворе содержаться в виде молекул.
Могут ли катионы цинка взаимодействовать с водой? Тогда
Гипотеза имеет смысл, так как при этом образуется мало диссоциирующий ион 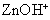 , прочно удерживающий гидроксид-ион. , прочно удерживающий гидроксид-ион.
Может ли гидролиз продолжаться дальше с образованием основания?
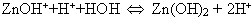
Не может, так как это приведет к удвоению концентрации протонов, что неминуемо сдвинет равновесие в сторону обратной реакции. Записываем уравнение гидролиза в тетради
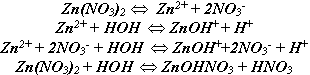
Из данной системы возможен частичный уход продуктов
взаимодействия. Как правило, растворимость основных солей значительно
меньшая, чем средних, а вероятность их образования в данной системе
большая: 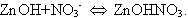
При длительном хранении подобных солей на дне емкости образуется осадок в виде основных солей. Учащимся предлагается ответить на вопросы:
- Почему гидролиз подобных солей не идёт до конца, хотя и одно из веществ частично выводится из сферы реакции?
Предполагаемый ответ: образование
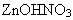 увеличивает концентрацию катионов водорода, что неминуемо приведет к
обратной реакции. А основные соли не могут существовать в кислой среде
увеличивает концентрацию катионов водорода, что неминуемо приведет к
обратной реакции. А основные соли не могут существовать в кислой среде
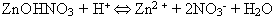 . .
- Как можно предотвратить образование нежелательных осадков?
Предполагаемый ответ: подкислить раствор соответствующей кислотой,
чтобы не вводить в него инородных анионов. Искусственное увеличение
концентрации катионов водорода препятствует образованию основных солеи.
Разбирают все возможные варианты взаимодействия частиц в данной системе. Учащиеся отвечают на вопросы:
- Почему среда в данной системе кислая?
- Какие соли будут вести себя в растворе подобным образом?
Выслушав ответы, делают вывод: соли,
образованные катионами слабого основания и анионами сильной кислоты,
подвергаются гидролизу, так как катионы слабого основания вызывают
сдвиг равновесия диссоциации воды в сторону образования катионов
водорода (гидроксония) от которых среда приобретает, кислую среду, т. е. 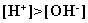 . .
Состав третьей системы и варианты возможных взаимодействий ее
частиц предлагается вывести самим учащимся. После чего делают вывод:
соли, образование катионами сильного основания и анионами сильной
кислоты, гидролизу не подвергаются, в растворе сохраняется равенство 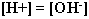 . .
После этого обращается внимание учащихся на таблицу растворимости
солей, и спрашивают: к какому типу относятся те соли, против которых
стоит прочерк. Эти соли образованы катионами слабых оснований и
анионами слабых кислот; они полностью разлагаются водой.
В заключение отмечают, что гидролиз солей — процесс обратимый и
динамическое равновесие этого процесса во многом зависит от
температуры, концентрации. Равновесие может быть сдвинуто в сторону
образования продуктов гидролиза при кипячении.
Разбавление растворов также увеличивает степень гидролиза.
Демонстрируют гидролиз хлорида железа (III) при кипячении.
Гидролиз используют в химической и пищевой промышленности. На нем
основаны важнейшие реакции в живых организмах, моющие средства – это
легко гидролизирующиеся вещества.
IV. Закрепление знаний и проверка усвоения материала учащимися.
Задание 1. Напишите уравнение гидролиза солей, указав среду раствора: 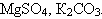 . .
Предполагаемый ответ (проверяется по кодопленке):
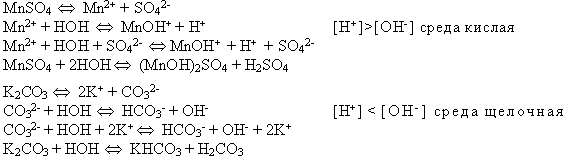
Задание 2. Подчеркните формулы солей, которые в растворе не подвергаются гидролизу: 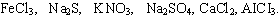
V. Задание на дом.
Обычное мыло представляет собой натриевую соль
органической кислоты, которую можно изобразить условной формулой NaR.
Напишите уравнение реакции гидролиза.
| 
