Оборудование. Мультимедийный проектор.
Домашнее задание к уроку. Представления об
атомах и элементах у различных ученых (готовится
в виде кратких сообщений, желательно с цитатами
из работ авторов).
На предыдущем уроке при объяснении домашнего
задания было показано несколько слайдов.
ХОД УРОКА
«Распространеннейшие в природе
простые тела
имеют малый атомный вес, а все элементы с малым
атомным весом характеризуются резкостью
свойств.
Они поэтому суть типичные элементы».
Д.И.Менделеев
Учитель. Первые представления об
элементах мы находим уже в греческой науке, но
тогда под элементами подразумевались невесовые
и невещественные категории. Аристотель
рассматривал четыре элемента – землю, воздух,
огонь и воду. В средние века алхимики прибавили к
ним еще ртуть, серу и соль. Однако только немногие
алхимики понимали термин «элемент» в
философском смысле Аристотеля. Ошибка была в том,
что понятие «элемент» смешивали с понятием
«вещество» того же наименования. Подобное часто
происходит и у начинающих изучать химию. Таким
образом сформировалась мысль о вещественности
элементов, из комбинаций которых состоят разные
вещества. Потом появилась мысль о возможности
взаимного превращения веществ, например
металлов в золото. Неудачи таких попыток
постепенно привели алхимиков к мысли, что
вещества, не разлагаемые физическими и
химическими методами, являются действительно
химическими элементами, из которых построены
сложные вещества.
1-й ученик. Такую мысль в XVII в.
высказывал Р.Бойль. Бойль стремился определить
индивидуальность элементов, изучая
специфические свойства тел, которые они образуют
(реакции осаждения, цветные реакции).
2-й ученик. В XVIII в. эту мысль развил
А.Лавуазье.
3-й ученик. Д.Дальтон считал, что все
атомы одного химического элемента тождественны
между собой. (Он ввел знаки химических элементов.)
«Я, – писал Дальтон, – избрал слово атом для
обозначения... первичных частиц... потому, что это
слово кажется мне значительно более
выразительным; оно включает в себя представление
о неделимости, чего нет в других обозначениях».
Иллюстрируя свое понимание атома, Дальтон
приводил такой пример: «…я называю первичную
частицу угольной кислоты сложным атомом. Однако,
хотя этот атом и может быть разделен, но,
распадаясь при таком делении на уголь и кислоту,
он перестает уже быть угольной кислотой».
Учитель. Постепенно список
«элементов» как результат многовекового опыта
по разложению веществ увеличивался, но в этом
списке наряду с вещественными сохранялись и
невещественные «элементы» – кислород, азот,
сера, едкий натр, светород, теплород.
4-й ученик. Первым методом открытия
новых «элементов» был анализ минералов, причем
критерием нового «элемента» было выделение
вещества с новыми реакциями, а затем и самого
простого вещества. Иногда промежуток времени
между этими этапами составлял десятки лет. Так,
фтор в виде соединений был открыт А.М.Ампером в 1810
г., но впервые выделен в виде простого вещества
только в 1886 г. А.Муассаном. Это объяснялось также
тем, что, с одной стороны, некоторые соединения
долгое время принимали за «элементы» (оксиды
щелочных металлов), с другой стороны, некоторые
простые вещества считали оксидами неизвестных
«элементов» (хлор – оксидом «мурия»). Большое
количество элементов было открыто путем
химического анализа. После введения в химическую
практику новых физических методов с помощью
электрического тока были выделены калий, натрий
и кальций. При помощи спектрального анализа были
открыты рубидий и цезий.
5-й ученик. Немецкий ученый Август
Кекуле обратился к своему коллеге Карлу Венцелю
с предложением организовать международный
конгресс для достижения единства в химии и
разрешения спорных проблем. Венцелю идея
понравилась, и он взял на себя обязанности
организатора и устроителя конгресса. К этому был
привлечен также Адольф Вюрц, согласившийся вести
заседания и быть секретарем. В марте 1860 г. они
собрались в Париже и отпечатали обращение ко
всем выдающимся химикам. 45 ученых подписали это
обращение, среди них значатся известные русские
химики Н.Н.Бекетов, Н.Н.Соколов и Н.Н.Зинин.
6-й ученик. Конгресс открылся 3
сентября 1860 г. в Карлсруэ, где Венцель преподавал
в Политехническом институте. Участникам
конгресса предстояло сделать выбор по тем
вопросам, которые имели жизненно важное значение
для развития химии в целом. В сущности, речь шла о
том, быть ли химии на старых позициях или принять
воззрения А.Авогадро и Ш.Ф.Жерара, открывавшие
перед ней новые перспективы.
Сторонником первой точки зрения был
французский академик, прославленный ученый
Ж.Дюма. «Дюма… – писал Д.И.Менделеев, принимавший
участие в конгрессе, – старался поставить
пропасть между старым и новым, искусственно
уладить дело об обозначениях, предлагая в
неорганической химии оставить старое
обозначение, а в органической – принять новые...
При этом Дюма прекрасно характеризовал оба
существующие направления. Одно, говорил он,
представляет ясное последование за Лавуазье,
Дальтоном и Берцелиусом. Исходная точка для
ученых этого образа мыслей есть атом, неделимое
простое тело; все прочее есть сумма атомов,
величина, производная от первой. Другая партия
идет по пути… Жерара; она берет готовые тела и
сравнивает их; она берет частицы тела, отыскивает
изменения и сличает их физические свойства.
Первая партия все сделала для минеральной химии,
в органической она до сих пор бессильна, потому
что здесь химия еще немного может создать из
элементов. Вторая партия, несомненно, сильно
двинувшая органическую химию, ничего не сделала
для минеральной». Дюма, свидетельствует далее
Менделеев, призывал и тех и других идти своей
дорогой.
7-й ученик. Сторонником другой точки
зрения был Станислао Канниццаро. Его речь
потрясла слушателей. «Я не могу… передать того
воодушевления, той здравой энергии, вполне
сложившегося убеждения, которые так
могущественно действовали на слушателей», –
отзывался о речи Канниццаро Менделеев. На
конгрессе Канниццаро раздал оттиски своей книги
«Краткое изложение курса химической философии».
Читатели были поражены четкостью изложения,
убедительностью, с которой устранялись
разногласия, и открывавшимися в связи с этим
перспективами развития экспериментальной науки.
«Я читал книгу неоднократно и был поражен
ясностью, с какой она освещала важнейшие спорные
вопросы, – писал тогда известный химик Лотар
Мейер. – С моих глаз как бы спала пелена, исчезли
сомнения, и вместо них возникло чувство самой
спокойной уверенности».
Гипотезу Авогадро Канниццаро назвал
краеугольным камнем развития атомной теории
Дальтона, которая, основываясь только на весовых
и объемных соотношениях, становилась
непригодной для экспериментальных исследований.
Не надо удивляться, утверждал он, необходимости в
гипотезе Авогадро для понимания законов. Именно
неприятие идей Авогадро и привело к неудачам
многих химиков и даже такого прославленного
ученого, как Берцелиус.
Канниццаро c огромным воодушевлением произнес
свою речь, и члены конгресса, несмотря на те
несогласия, которые были между ними до этого,
встретили ее почти единодушным одобрением. Когда
предложили резолюцию, в которой
характеризовалось различие понятий частицы
(молекулы) и атома, то все проголосовали «за».
Лишь одна чья-то рука робко поднялась при вопросе
«кто против?», но и она тут же опустилась.
После конгресса в Карлсруэ отошли в прошлое
разногласия, стоявшие на пути развития
экспериментальных определений в химии, а атомный
вес стал важнейшей характеристикой элемента.
8-й ученик. М.В.Ломоносов писал:
«Элемент есть часть тела, не состоящая из
каких-либо других меньших тел». Ломоносов более
чем на сто лет опередил всех химиков Европы. В
своей незавершенной работе «Элементы
математической химии» он дал представление о
строении вещества, подобное тому, что приняли
химики лишь после конгресса в Карлсруэ. Он писал,
что «корпускула (так он называл молекулу) –
собрание элементов (т.е. атомов) в одну
незначительную массу. Корпускулы однородны, если
состоят из одинакового числа одних и тех же
элементов, взаимосоединенных одинаковым
образом. Корпускулы разнородны, когда элементы
их различны и соединены разным образом или в
различном числе; от этого зависит бесконечное
разнообразие тел. Начало есть тело, состоящее из
однородных корпускул».
Учитель. Именно потому, что научная
истина не есть то, что принимается голосованием,
положение в химии после конгресса не стало
идиллическим. Борьба продолжалась. Одни были
полностью «за» атомно-молекулярную теорию;
другие принимали ее постольку, поскольку она
казалась неплохим «инструментом» познания;
третьи не признавали ее совсем. И так до тех пор,
пока атом не стал для науки реальностью.
Съезд химиков явился толчком к дальнейшему
движению, в частности к созданию периодического
закона. Менделеев писал: «Главное понятие, с
которым возможно приступить к объяснению
периодической закономерности, состоит именно в
коренном различии представлений об элементах и
простых телах… Понятия и слова «простое тело» и
«элемент» нередко смешивают между собою...
Простое тело есть вещество, металл или металлоид,
с рядом физических признаков и химических
реакций... Под именем элемент должно
подразумевать материальные составные части
простых и сложных веществ…»
Этим понятием мы пользуемся и в настоящее
время, хотя физический смысл его объясняем на
основании современных представлений о строении
атома.
 Презентация
элементов 1–3-го периодов Презентация
элементов 1–3-го периодов
Выберите интересующий вас элемент.
Выбираем элемент углерод 6С.

На примере углерода учитель объясняет различие
понятий «элемент» и «простое вещество».
| Углерод – это элемент, который существует в
природе либо в виде алмаза, известного всем
драгоценного камня, либо в виде не менее
известного графита. Углерод – один из
немногочисленных элементов «без роду, без
племени». История общения человека с этим
веществом уводит во времена доисторические. Имя
первооткрывателя углерода неизвестно,
неизвестно и то, какая из форм элементарного
углерода – алмаз или графит – была открыта
раньше. Люди не сразу пришли к пониманию того,
что благороднейший алмаз и невзрачный уголь –
близнецы. Между тем, установить это было совсем
просто: в один прекрасный день с помощью линзы
сконцентрировали солнечные лучи на кристаллике
алмаза, помещенного под стеклянный колпак.
Алмаз... сгорел, а под колпаком образовался
углекислый газ – тот же самый, что образуется при
горении угля.
И графит, и алмаз состоят из одинаковых
углеродных атомов. Любой кристалл алмаза, даже
огромный, шестисотграммовый «Куллинан», – это по
существу одна молекула, состоящая из идеально
упакованных атомов углерода.
Особенности молекулярного строения объясняют
огромную разницу в свойствах графита и алмаза.
Графит мягкий, легко расслаивается, алмаз –
самое твердое вещество в природе.
Графит отлично проводит тепло и электричество,
алмаз — изолятор.
Графит совершенно не пропускает света, алмаз
прозрачен.
Существует более 6,5 млн веществ, называемых
органическими. Что их объединяет? Представьте
себе, во всех органических веществах обязательно
есть элемент углерод! |
 Углерод –
алмаз Углерод –
алмаз
Прозрачные кристаллы, после огранки
превращаются в бриллианты.

Решетка кубическая, а = 3,5 нм.
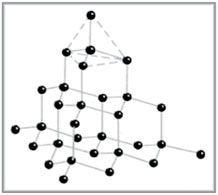
 Углерод – графит Углерод – графит
Вещество черного цвета с металлическим
блеском.

Решетка гексагональная, а = 2,45 нм, с = 6,7
нм.

 Проверка
усвоения знаний Проверка
усвоения знаний
Натрий 11Na – элемент и вещество.
Просмотрите презентацию и определите, где речь
идет об элементе, а где о веществе.
| Натрий по своей распространенности в природе
занимает 6-е место среди элементов. Присутствует
в атмосфере Солнца и в межзвездном пространстве.
Содержание натрия в земной коре – 2,3%, в морской
воде – 1,05%. Натрий входит в состав человеческого
организма, в крови содержится около 0,6% NаСl.
Осмотическое давление крови поддерживается на
необходимом уровне в основном за счет хлорида
натрия.
Наибольшее количество натрия связано в
соединении с хлором. Соль, или, как ее называют
химики, хлорид натрия, образует мощные отложения.
В год каждый человек с пищей потребляет от 8 до 10
кг соли. Недаром говорят: «Чтобы узнать человека,
надо с ним пуд соли съесть». Оказывается, это не
так уж много и по весу, и по времени: за год вдвоем
и будет съеден пуд
(16 кг) соли.
Огромные количества соли содержат в себе воды
морей и океанов. Солью, извлеченной из морских
вод, можно было бы засыпать всю сушу земного шара
слоем в 130 м. Так велико количество соли!
Интересный факт установили канадские ученые из
медицинского университета в Торонто. У
вспыльчивых, раздражительных людей натрий
усваивается плохо и быстро выводится из
организма, а у спокойных и  доброжелательных
постоянно испытывающих положительные эмоции,
этот элемент усваивается хорошо. доброжелательных
постоянно испытывающих положительные эмоции,
этот элемент усваивается хорошо.
Натрий – это легкоплавкий металл
серебристо-белого цвета, на воздухе легко
покрывается пленкой, состоящей из карбонатов,
оксидов и гидроксидов. |
Решетка кубическая, а = 4,28
нм.

Итоги урока формулируются и записываются в
тетрадь в виде современных определений понятия
«элемент» и «простое вещество».
|

