Цели урока.
Продолжить формирование системы знаний о
классах органических соединений и генетической
связи между ними; способствовать закреплению
понимания взаимосвязи применения, свойств и
химического строения веществ.
Задачи урока.
1. Закрепить знания о сложных эфирах, их
номенклатуре, реакции этерификации.
2. Дать понятия о физических и химических
свойствах сложных эфиров, механизме реакции
этерификации.
3. Развить понятие о водородной связи, взаимном
влиянии атомов, воздействии этих явлений на
свойства веществ.
4. Способствовать развитию эрудиции,
логического и ассоциативного мышления учащихся.
Методы и приемы: словесные, наглядные,
практические – в логической взаимосвязи.
ХОД УРОКА
Оргмомент
Тема урока «Сложные эфиры. Жиры». Форма
проведения урока – лекция-шоу. Вам, конечно,
знакомо английское слово «show». Оно означает
«показывать». Заимствована лекция-шоу из
интенсивных методик, применяемых в обучении
бизнесменов. Лекция-шоу предполагает донесение
основной информации до учащихся через
пиктограммы – логические рисунки, где в символах
и условных знаках «зашифровано» содержание
изучаемого. Чтобы расшифровать пиктограмму,
нужно понять ее внутреннюю логику, соединив
усилия восприятия, воображения и мышления,
активно работая над изучаемым материалом, в
результате чего содержание усваивается прочно.
Как девиз лекциям-шоу очень соответствуют слова
А.Эйнштейна: «Самое лучшее, что может быть, – это
видеть и понимать». Внимательно смотреть,
стараться понять и применять к учебной ситуации
знания, которыми вы владеете, – все это требуется
от вас сейчас на уроке.
Подготовка к изучению нового
материала
Сначала приведем в активное состояние
имеющиеся у вас знания. На доске даны названия
веществ: калий, медь, оксид магния, оксид
углерода(IV), гидроксид натрия, карбонат натрия,
серная кислота, этанол, этановая кислота,
этаналь, хлор, хлороводород.
С какими из перечисленных веществ вступит в
реакцию:
а) этиловый спирт (шесть реакций);
б) уксусная кислота (семь реакций)?
Желающие учащиеся записывают на доске по два
уравнения реакций и комментируют, какие свойства
отражают эти уравнения, какой тип реакции и как
называются продукты.
Вывод: спирты и карбоновые
кислоты взаимодействуют между собой с
образованием сложных эфиров.
Изучение нового материала
(последовательная демонстрация
и комментирование пиктограмм)
Пиктограмма 1 отражает то, что реакция
карбоновой кислоты со спиртом – это реакция
замещения, но имеет собственное название:
реакция этерификации (от греч.  – эфир). А какое значение
вкладывали в слово «эфир» в древности? – Воздух. – эфир). А какое значение
вкладывали в слово «эфир» в древности? – Воздух.
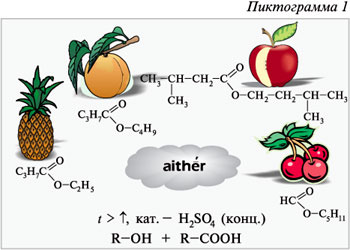
Эфирами были названы рассматриваемые вещества
в эпоху алхимии, когда названия давались не
случайно, а в соответствии с ярко выраженными их
свойствами. Самым «выдающимся» свойством эфиров
является летучесть, проявляющая себя в наличии
запаха.
Назовите эфиры, формулы которых приведены на
пиктограмме 1. Обратите внимание на свойственный
эфирам запах: этилбутирату – ананаса,
бутилбутирату – персика, пентилформиату –
вишни, изопентилацетату – груши, этилбензоату –
жасмина, изоамиловому эфиру изовалериановой
кислоты – яблока.
С какой особенностью строения химик свяжет
наличие у вещества выраженного запаха? С
отсутствием между молекулами водородных связей.
А почему между молекулами сложных эфиров
водородные связи не образуются? Нет связи О–Н, в
которой атом водорода соединен с
электроотрицательным атомом.
Итак, водородных связей между молекулами нет, а
температуры кипения сложных эфиров достаточно
высокие. Как химик объяснит эту особенность
сложных эфиров? Достаточно длинные молекулярные
цепи – межмолекулярное притяжение значительно.
Какие еще физические свойства химик может
предсказать для сложных эфиров? Они хорошо
растворяются в воде за счет образования
водородных связей между атомами водорода
молекул воды и карбонильными атомами кислорода
молекул эфира. Составьте схему водородной связи
на любом примере.
Обратим еще раз внимание на реакцию
этерификации. При каких условиях она протекает?
Необходимы повышенная температура и наличие
концентрированной серной кислоты. Какова роль
серной кислоты? Это катализатор для ускорения
реакции и водопоглощающее средство для смещения
химического равновесия в сторону образования
продуктов реакции.
Составьте уравнения реакций образования
эфиров, указанных на пиктограмме 1. При
составлении уравнений реакций этерификации
обратите внимание на то, что кислоты теряют
гидроксигруппу, а спирты – атом водорода. Почему
реакция протекает именно так, объясняется ее
механизмом. Для понимания этого механизма
вспомним взаимное влияние атомов в молекулах
карбоновых кислот (пояснение заготовленной на
доске схеме).
Пиктограмма 2 отражает то, что, образно
говоря, в молекулах карбоновых кислот доминирует
 -связь,
стабилизированная p-
-связь,
стабилизированная p- -сопряжением с одной из неподеленных
электронных пар гидроксильного атома кислорода
и утратившая вследствие такой стабилизации
способность к самым характерным для p-связи
реакциям – реакциям присоединения. Единственное
исключение – реакция со спиртами, этерификация,
механизм которой, как мы сейчас увидим, включает
присоединение за счет разрыва -сопряжением с одной из неподеленных
электронных пар гидроксильного атома кислорода
и утратившая вследствие такой стабилизации
способность к самым характерным для p-связи
реакциям – реакциям присоединения. Единственное
исключение – реакция со спиртами, этерификация,
механизм которой, как мы сейчас увидим, включает
присоединение за счет разрыва  -связи. -связи.

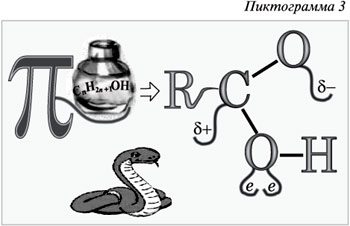
Пиктограмма 3 на образном языке
демонстрирует, что пристрастие к спиртному
разрушительно даже для химических связей, а для
человека – тем более.
Методом меченых атомов доказано, что молекулы
карбоновых кислот в реакции этерификации,
которая обычно проводится в присутствии сильных
минеральных кислот, отщепляют гидроксигруппу, а
молекулы спиртов – атом водорода:
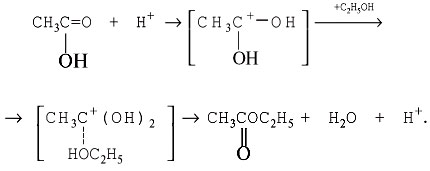
Важнейшее свойство сложных эфиров – гидролиз.
Что такое гидролиз? Разложение вещества водой (от
греч.  – вода и – вода и  – разложение).
Гидролиз сложных эфиров – реакция, обратная
этерификации. В формуле сложного эфира
«кислотная» часть включает карбонильную группу,
а «спиртовая» связана с «мостиковым» атомом
кислорода. Водород из молекулы воды соединяется
со «спиртовой» частью, а гидроксигруппа – с
«кислотной» частью. – разложение).
Гидролиз сложных эфиров – реакция, обратная
этерификации. В формуле сложного эфира
«кислотная» часть включает карбонильную группу,
а «спиртовая» связана с «мостиковым» атомом
кислорода. Водород из молекулы воды соединяется
со «спиртовой» частью, а гидроксигруппа – с
«кислотной» частью.
Как вы считаете, чем будут отличаться продукты
реакции, если гидролиз проводится не водой, а
водным раствором щелочи? (Образуется не
карбоновая кислота, а ее соль, и реакция
необратима.)
Составьте в тетрадях уравнения гидролиза:
пентилформиата – водой,
этилбутирата – водой,
пропилформиата – гидроксидом калия,
метилбутирата – гидроксидом лития,
изопропилацетата – гидроксидом натрия.
Прежде чем прокомментировать следующую
пиктограмму, составьте уравнения реакций:
этилен + вода,
тримеризация ацетилена,
хлорбензол + гидроксид калия (t, p),
оксид углерода(II) + расплав гидроксида калия,
гидрирование угля,
гидрирование ацетилена,
спиртовое брожение глюкозы.
Проверьте составленные уравнения, сопоставляя
их с написанными на доске.
Пиктограмма 4 имеет отношение к
реакциям, с которыми мы давно знакомы,
многократно составляли их уравнения в
«генетических цепочках» и задачах. Объединяет
эти реакции то, что впервые их осуществил
французский химик Пьер Эжен Марселен Бертло –
«король органического синтеза», как называли его
современники и называют до сих пор историки
химии. Он был не только великим химиком, но и
великим человеком – умным, с умелыми руками и
горячим сердцем.

На пиктограмме 4 – портрет Бертло в королевской
короне, рядом прибор, в котором проводится
большинство органических синтезов, в том числе
синтез сложных эфиров. Прибор состоит из
круглодонной колбы (для равномерного подогрева)
с боковым отводом (это колба Вюрца, в ней
протекает синтез), водяного холодильника Либиха,
где конденсируются продукты реакции, и аллонжа,
направляющего конденсат в колбу-приемник.
Великому химику Бертло был дан еще редкий дар –
дар большой любви. Бертло очень любил свою жену,
испытывал потребность видеть ее постоянно. В его
лаборатории была отгорожена стеклом кабинка, где
мадам Бертло читала, вязала, пока ее муж
занимался синтезами. Он всегда мог подойти к ней,
поговорить, подержать за руку, и это общение
вдохновляло «короля органического синтеза» на
новые подвиги во благо науки.
Судьба супругов Бертло соответствует словам
Александра Грина: «Они жили счастливо и умерли в
один день». Действительно, Бертло не смог
пережить утраты жены: она умерла утром, он –
вечером. Похоронили их в одной могиле в соборе
Парижской богоматери, где хоронят самых
выдающихся граждан Франции.
Одним из величайших достижений химика Бертло
был синтез жиров – веществ, характерных для
живых организмов, т.е. органических
веществ в прямом смысле этого слова.
Синтезировав жиры, Бертло нанес сокрушительный
удар по теории витализма – божественного
происхождения органических веществ.
Пиктограмма 5 отражает то, что в работах
по синтезу жиров Бертло использовал результаты
аналитической деятельности своего современника,
французского химика-органика Мишеля Эжена
Шевреля, который изучил состав многих жиров и
сделал вывод, что жиры – это сложные эфиры
трехатомного спирта глицерина и карбоновых
кислот, чаще всего стеариновой С17Н35СООН,
пальмитиновой С15Н31СООН, масляной С3Н7СООН,
олеиновой С17Н33СООН, линолевой С17Н31СООН
и линоленовой С17Н29СООН. Последние
три кислоты являются непредельными.
Как мы понимаем термин «непредельность»? Как
практически доказать, что молекулы непредельных
кислот содержат  -связи? -связи?
Кислоты, входящие в состав жиров, называются
«жирными кислотами». Насыщенные кислоты
образуют твердые жиры, обычно они животного
происхождения (исключение – кокосовое масло).
Непредельные кислоты образуют жидкие жиры, они
обычно растительного происхождения (исключение
– рыбий жир).

Составьте в тетрадях формулы: триолеата
глицерина, трипальмитата глицерина, тристеарата
глицерина.
Как все сложные эфиры, жиры подвергаются
водному и щелочному гидролизу. Щелочной гидролиз
сложных эфиров называется омылением.
Составьте в тетрадях уравнения омыления:
тристеарата глицерина – гидроксидом натрия,
трипальмитата глицерина – гидроксидом калия.
Эти реакции используются для получения
глицерина и мыла: твердого С17Н35СООNa и
жидкого С15Н31СООК.
Жидкие жиры подвергаются гидрированию,
например триолетат глицерина переходит в
тристеарат глицерина (составить уравнение
реакции). Условия гидрирования жидких жиров
общие для реакций гидрирования (t, p, кат.
Ni). Составленное уравнение реакции отражает
химизм производства маргарина из растительного
масла.
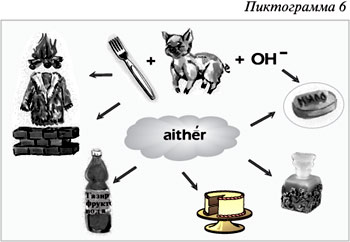
Пиктограмма 6 содержит информацию о
значении сложных эфиров и жиров. Сложные эфиры
используются как растворители, ароматизирующие
добавки в парфюмерной, фармацевтической и
пищевой отраслях промышленности. Жиры –
основной источник энергии в живых организмах.
При расщеплении 1 г жира освобождается
существенно больше энергии, чем в случае белков и
углеводов. Жировые прослойки выполняют
структурные и защитные функции (жировые капсулы
сердца, печени, почек), теплорегулирующую функцию
(у животных – обитателей Севера и Антарктиды
очень развита жировая подкожная прослойка). Жиры
являются источником эндогенной воды (горб
верблюда), выполняют гормональные функции,
например жировую природу имеют половые гормоны.
Витамины одного из классов называются
«жирорастворимые», и жиры пищи способствуют
усвоению этих витаминов (к ним относятся,
например, витамины А и D). Как уже отмечалось, жиры
используются для производства мыла и глицерина.
Подведение итогов урока. Оценить наиболее
активных учащихся, задать вопрос: «Понравилась
ли вам такая форма проведения урока?»
Домашнее задание.
| 
