| Тип урока: Урок теоретического исследования –
введение основ базовых знаний с элементами повторения.
Цели урока:
Дидактические:
- совершенствование понятий "водород – химический элемент”,
"водород - простое вещество”;
- прогнозирование физических свойств водорода на основе
причинно-следственной связи "состав – строение - свойства”;
- моделирование способов получения водорода в лаборатории и в
промышленности;
- моделирование способов собирания водорода в лаборатории;
- усвоение закономерности нахождения водорода в природе.
Психологические:
- развитие логического мышления, внимания, памяти;
- формирование способности к адекватному само – и
взаимоконтролю;
- совершенствование умения работать с лабораторным
оборудованием и реактивами.
Воспитательные:
- формирование научного мировоззрения;
- воспитание культуры общения через работу в коллективе ученик –
ученик, ученик – учитель;
- формирование практических умений работы с химическим
оборудованием и реактивами.
Оборудование:
- "Периодическая система Д.И. Менделеева”.
- Таблица "Способы собирания газов.”
- Прибор для электролиза воды.
- Приборы для собирания газов вытеснением воздуха и над
водой.
Реактивы: Соляная кислота, цинк.
План урока
- Ориентировочно-мотивационный этап.
- Актуализация знаний.
- Постановка учебной задачи.
- Операционно-исполнительный этап.
- Водород в природе.
- Получение водорода в промышленности, в лаборатории. Демонстрация
"Электролиз воды”.
- Способы собирания водорода в лаборатории.
- Лабораторная работа по получению, собиранию и доказательству
водорода.
- Демонстрация "Собирание водорода над водой, его доказательство”.
- Физические свойства водорода.
- Рефлексивно-оценочный этап.
- Обобщение изученного материала.

- Самооценка.
- Домашнее задание.
- Постановка учебной задачи следующего урока.
Содержание урока
I. Ориентировочно-мотивационный этап.
1. Актуализация знаний.
Учитель: Мы продолжаем путешествие по огромной и
удивительной стране "Химия”, в которой
проживают различные вещества. Обычно, чтобы подчеркнуть
значение того или иного вещества, говорят: если бы
его не было, то случилось бы то-то и то-то. Как правило, это не более,
чем риторический прием. А водород может и не быть когда-нибудь, потому
что он непрерывно сгорает в недрах звезд, превращаясь в благородный газ
гелий. За счет выделяемой при этом энергии существует жизнь на нашей
планете. Вот об этом веществе мы поведем сегодня наш рассказ. Вспомним,
с какого уровня мы начали рассматривать водород?
Ученик: С атомарного, со строения атома водорода.
Учитель: Далее, к какому уровню организации
водорода мы перешли?
Ученик: К молекулярному, рассмотрели образование
химической связи в молекуле водорода.
Учитель: Предлагаю в группах подготовить ответы на
вопросы.
Задание для учащихся первой группы: вспомнить положение
водорода в периодической системе, указать группу , период, атомный
номер, относительную атомную массу, заряд ядра, число протонов,
нейтронов, электронов.
Задание для учащихся второй группы: вспомнить электронную и
электронно-графическую формулы водорода, указать характерные степени
окисления водорода.
Задание для учащихся третьей группы:вспомнить
образование молекул водорода. Составить электронную и структурную
формулы вещества. Указать вид связи, тип кристаллической решетки.
Спрогнозировать физические свойства водорода.
(Вопросы обсуждаются в группах. Ответы на
эти вопросы заслушиваются у доски)
Ученик от 1 группы.
Водород – химический элемент первой группы главной подгруппы первого
периода, атомный номер 1, заряд ядра +1, протонов в ядре 1, нейтронов
0,
число электронов 1.
Ученик от 1 группы.
Строение атома водорода 1S', на внешнем уровне один неспаренный
электрон, может проявлять восстановительные и окислительные свойства.
Характерные степени окисления -1, 0, +1.
Ученик от 1 группы.
Атом водорода имеет один валентный электрон, При взаимодействии двух
атомов водорода образуется молекула водорода с ковалентной неполярной
связью:
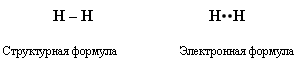
Совокупность молекул водорода образуют простое вещество водород. Это
вещество в твердом состоянии имеет молекулярную кристаллическую
решетку.
Можно, зная свойства веществ с этим типом кристаллической решетки,
спрогнозировать физические свойства водорода – газ, обладает
летучестью, низкими температурами плавления и кипения.
2. Постановка учебной задачи.
Учитель: Мы вспомнили характеристику водорода на
атомном и молекулярном уровне, к какому уровню организации водорода мы
подошли?
Ученик: К вещественному.
Учитель: Следовательно, на уроке мы начнем изучать
водород как вещество. Как понять выражение "изучить вещество”?
Ученик: Где используется это вещество.
Ученик: Какими свойствами оно обладает, в какие
реакции вступает.
Ученик: Как можно получить это вещество.
Учитель: Правильно, сформулируем тему урока и
запишем ее на доске и в тетради:
"Водород. Нахождение в природе, его получение и физические
свойства”.
II. Операционно-исполнительный этап
Учитель: Что значит рассмотреть нахождение водорода
в природе?
Ученик: Это значит выяснить, где встречается
водород в окружающем нас мире.
Учитель: Вспомним, из каких сфер состоит наша
планета?
Ученик: Атмосферы, гидросферы, литосферы.
Учитель: А все живое на земле какую сферу
представляют?
Ученик: Биосферу.
Учитель: Входит ли водород в состав гидросферы?
Ученик: Гидросфера состоит из воды, в состав
молекулы воды входит элемент водород.
Учитель: Есть ли водород в литосфере? Если да, то
где?
Ученик: В природный газ, нефть
водород входит как элемент.
Учитель: Есть ли атомы водорода в нашем организме?
Ученик: Да, водород как элемент входит в состав
белков, жиров, углеводов, нуклеиновых кислот.
Учитель: А в атмосфере водород практически не
встречается. Как простое вещество водород входит в состав вулканических
газов. И давайте вернемся к началу нашего урока. Солнце обогревает
нашу землю за счет превращения водорода в гелий. Следовательно, водород
– элемент космоса. Он составляет около половины массы солнца и
большинства звезд, основную часть межзвездной среды и туманностей.
(Учитель предлагает оформить выше изложенное в тетрадь и
дать само оценку).
Учитель: Обсудим вопрос получения водорода. Зная
распространение водорода в природе, предложите способы его получения.
Ученик: Раз водород входит в состав воды, нефти,
газа, следовательно, его можно получить из этих веществ и смесей.
Учитель: В больших масштабах, т.е. в
промышленности, его можно получить электролизом воды

Можно использовать для этого нефть, газ, кокс. Но с этими способами
получения водорода мы познакомимся позже. Можно ли использовать эти
способы в лаборатории?
Ученик: Электролиз воды можно использовать для
получения водорода.
Учитель: Да, но в лаборатории используются более
доступные реакции, для протекания которых не нужно электрического тока,
нагревания. Достаточно вещества привести в соприкосновение и реакция с
выделением водорода пошла. Поэтому на уроке мы будем получать водород
взаимодействием цинка с разбавленной серной кислотой:
Zn + H2SO4
= ZnSO4+ H2
Мы получили водород, но нам нужно убедиться в этом. А для этого мы
должны собрать газ водород. Какие способы собирания газов вам известны?
Ученик: Газы можно собирать над водой и вытеснением
воздуха.
Учитель: Как надо держать сосуд для сбора водорода?
Чтобы ответить на этот вопрос, сравните молярные массы водорода и
воздуха 2 и 29 грамм/моль.
Водород легче воздуха в 14.5 раз, следовательно, сосуд для сбора
газа держим вверх дном. (Работа с таблицей "Способы собирания
газов”)
Учитель: При обычных условиях водород малорастворим
в воде. Можно ли его собрать под водой.
Ученик: Да. (Работа с таблицей "Способы
собирания газов”)
Учитель: Мы получили газ, собрали его, теперь его
нужно доказать. Как это сделать?
Ученик: Водород горит, надо к сосуду с водородом
поднести горящую спичку.
Учитель: А теперь от теории перейдем к практике.
Перед началом опыта прослушайте правила техники безопасности.
(После проведения инструктажа, учащиеся получают водород,
собирают его вытеснением воздуха и доказывают наличие газа)
Учитель: Вы обратили внимание, что у всех водород
горел по разному: у одних звук горящего водорода был более резкий, у
других более глухой. Как вы думаете, почему?
Ученик: Водород не имеет цвета, поэтому трудно
сказать, весь ли воздух в пробирке вытеснился водородом. Грязный водород
дает лающий звук при горении.
Учитель: Я же выделяющий водород соберу над водой, и
мы посмотрим, как горит чистый водород.
(Демонстрация опытов).
Учитель: Водород – горючий газ, образует с воздухом
и кислородом взрывоопасные смеси (гремучие смеси),
поэтому требует аккуратного обращения.
Водород хранят под большим давлением в баллонах из стали, окрашенных
в зеленый цвет.
Запишем уравнение горения водорода.
Ученик: 2H2+O2=2H2O
Учитель: При горении водорода образуется вода,
поэтому не случайно латинское название водорода Hydrogenium,
что в переводе обозначает "рождающий воду”.
Учитель: Предлагаю вам обобщить знания о физических
свойствах водорода, записать в тетради. (Учащиеся работают в своих
тетрадях и после проверки дают самооценку)
Учитель: Давайте проверим и, если нужно, сделаем
дополнения.
Ученик: Это газ, не имеет цвета, вкуса, запаха,
мало растворим в воде, в 14.5 раз легче воздуха, имеет низкие
температуры плавления и кипения.
Учитель: Для справки скажу, что он сжижается при
температуре -252.6 и затвердевает при -259 градусов Цельсия. Жидкий
водород самая легкая из известных жидкостей. Водород замечателен своей
теплопроводностью: нагретое тело, помещенное в атмосферу водорода,
остывает в 6 раз быстрее, чем на воздухе. Причина – легкие молекулы
имеют большую среднюю скорость теплового движения. И еще одним
удивительным свойством обладает свободный водород: в то время как в
воде он растворяется плохо (около 18 мл в 1 л
воды), его растворимость в некоторых материалах необычайно
высока. Например, 1 объем палладия может поглотить до 900 объемов
водорода. Растворяют водород и другие металлы, хотя в меньшей степени.
III. Рефлексивно-оценочный этап.
Учитель: Что нового мы узнали о водороде на
вещественном уровне?
Ученик: Способы получения водорода.
Ученик: Способы собирания водорода.
Ученик: Физические свойства водорода.
Ученик: Нахождение водорода в природе.
(Учитель предлагает оформить в виде схемы, что учащиеся
узнали о водороде на вещественном уровне).
Учитель: Завершая работу, дайте самооценку вашей
работе на уроке.
(Учащиеся дают самооценку работы на уроке).
Учитель: Для закрепления изученного материала
продумаем домашнее задание, чтобы закрепить понятия "элемент” и
"вещество” составьте в тетради по 3 предложения: водород – элемент,
водород – вещество.
Для закрепления ранее изученных формул решите задачу: ”Сколько
атомов водорода содержится в стакане воды”? Для тех, кто особенно
интересуется химией, предлагаю найти историческую справку об открытии
водорода, используя для этого дополнительную литературу. Начав изучение
водорода на вещественном уровне, как вы думаете, какие вопросы
остались вне поля нашей деятельности?
Ученик: Где используется водород.
Учитель: Применение водорода основано на его
свойствах, и не только физических.
Ученик: С какими другими веществами реагирует
водород?
Учитель: Химические свойства водорода и его
применение будут объектом нашего исследования на следующем уроке.
Благодарю всех за активную работу на уроке. До свидания.
| 
