Цели. Повторить и закрепить на основе
эксперимента понятия о составе и структуре
белковых молекул, приготовить водный раствор
яичного альбумина, изучить способы его
коагуляции и цветные качественные реакции.
Оборудование и реактивы.
Штатив с
пробирками (2 шт.), держатель для пробирок, водяная
баня (электрическая), пипетка на 5–10 мл, двойной
слой марли (2 фильтра), воронка стеклянная, трубка
стеклянная, санитарная склянка, химический
стакан на 50–100 мл, железный штатив с кольцом и
лапкой; лакмусовая бумага нейтральная, растворы
формалина (
NaCl ( = 10%), NaCl
(насыщ.), Pb(CH3COO)2, Pb(NO3)2,
CH3COOH
( = 10%), NaCl
(насыщ.), Pb(CH3COO)2, Pb(NO3)2,
CH3COOH
( = 1%), CH3COOH ( = 1%), CH3COOH ( = 10%), водный аммиак
(конц.), нитропруссид натрия Na2[Fe(CN)5NO] ( = 10%), водный аммиак
(конц.), нитропруссид натрия Na2[Fe(CN)5NO] ( = 5%), CH3COOH
(ледяная), = 5%), CH3COOH
(ледяная),
H2O (дистил.), NaOH ( = 15%), NaOH (конц.), CuSO4 ( = 15%), NaOH (конц.), CuSO4 ( = 5%), яичный белок (свежий), H2SO4
(конц.), HNO3 (конц.), соляная кислота,
трихлоруксусная кислота, 5-сульфосалициловая
кислота. = 40%,
нейтрализованный), = 5%), яичный белок (свежий), H2SO4
(конц.), HNO3 (конц.), соляная кислота,
трихлоруксусная кислота, 5-сульфосалициловая
кислота. = 40%,
нейтрализованный),
Белки – высокомолекулярные
соединения, состоящие из макромолекул, в которых
пептидной связью соединены между собой остатки
аминокислот. Белки при гидролизе распадаются с
образованием  -аминокислот. -аминокислот.

|
Первичная структура макромолекулы
белка
(последовательность чередования аминокислотных
остатков)
|
Задание 1. Многообразие
(и
трудности в синтезе) белков объясняется
возможностями перестановки остатков
аминокислот относительно друг друга. Число
перестановок Pn = 1•2•3•… •n = n! Если,
например, остатков аминокислот 4, Р4 = 24, если
10, то Р10 = 6 328 800. Составить формулы
возможных первичных структур трипептида из
остатков глицина, аланина и цистеина, назвать эти
трипептиды.
Вследствие одновременного наличия в молекуле
групп –СООН и –NH2 белки амфотерны. Многие
белки растворимы в воде, другие – только в
растворах нейтральных солей, третьи – в кислотах
и щелочах. Устойчивость растворов белков зависит
от заряда и степени гидратации белковой
молекулы. Уменьшение такой устойчивости ведет к
коагуляции (осаждению) белков, т. е. к разрушению
вторичной структуры. Коагуляция может быть и
обратимой. Денатурация (необратимая коагуляция)
происходит при действии концентрированных
минеральных и органических кислот, фенола,
формалина, спирта, алкалоидов, механических
факторов, при нагревании.
Различают первичную, вторичную, третичную и
четвертичную белковые структуры.
Свойства белков полностью зависят от их
аминокислотного состава. Присутствие в белках
определенных атомных групп (остатков
аминокислот) определяется характерными для них
цветными реакциями.
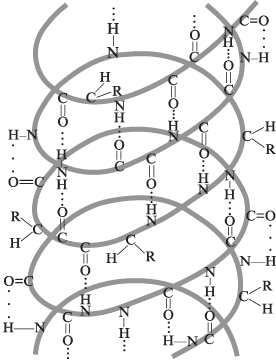
|
Вторичная структура белковой
молекулы
|
 Ксантопротеиновая
реакция. К 1 мл раствора белка добавить 5–6
капель концентрированной НNО3 до появления
белого осадка (или мути от свернувшегося под
влиянием кислоты белка). При нагревании раствор и
осадок окрасятся в ярко-желтый цвет (осадок почти
полностью гидролизуется и растворится). Смесь
охладить, добавить (осторожно, не взбалтывая) по
каплям избыток концентрированного водного
аммиака (или едкой щелочи) до щелочной реакции.
Выпадающий сначала осадок кислотного
альбумината растворится, жидкость окрасится в
ярко-оранжевый цвет. Реакция протекает при
наличии в белках остатков ароматических
аминокислот (фенилаланин, тирозин, триптофан). Ксантопротеиновая
реакция. К 1 мл раствора белка добавить 5–6
капель концентрированной НNО3 до появления
белого осадка (или мути от свернувшегося под
влиянием кислоты белка). При нагревании раствор и
осадок окрасятся в ярко-желтый цвет (осадок почти
полностью гидролизуется и растворится). Смесь
охладить, добавить (осторожно, не взбалтывая) по
каплям избыток концентрированного водного
аммиака (или едкой щелочи) до щелочной реакции.
Выпадающий сначала осадок кислотного
альбумината растворится, жидкость окрасится в
ярко-оранжевый цвет. Реакция протекает при
наличии в белках остатков ароматических
аминокислот (фенилаланин, тирозин, триптофан).
 Биуретовая реакция.
К 1–2 мл раствора белка добавить равный объем
щелочи, затем 2–3 капли разбавленного (почти
бесцветного) раствора медного купороса. Жидкость
окрасится в красно-фиолетовый цвет (при малом
содержании белка к его раствору в щелочи
осторожно прибавить 0,5–1 мл раствора CuSO4,
окраска появится на границе слоев). Реакция
обусловлена наличием в молекуле белка пептидных
группировок –СО–NН– и характерна для всех
белков. Окраска объясняется образованием
комплексных соединений меди.
Биуретовая реакция.
К 1–2 мл раствора белка добавить равный объем
щелочи, затем 2–3 капли разбавленного (почти
бесцветного) раствора медного купороса. Жидкость
окрасится в красно-фиолетовый цвет (при малом
содержании белка к его раствору в щелочи
осторожно прибавить 0,5–1 мл раствора CuSO4,
окраска появится на границе слоев). Реакция
обусловлена наличием в молекуле белка пептидных
группировок –СО–NН– и характерна для всех
белков. Окраска объясняется образованием
комплексных соединений меди.
Примечание
. Такой же эффект наблюдается у
веществ небелкового происхождения, если в них
содержатся группировки –СО–NH–, –СS–NH–,
например, у биурета NH2–CO–NH–СО–NH2.
 Расщепление щелочью.
В пробирку налить 0,5–1 мл неразбавленного белка,
добавить двойной объем концентрированного
раствора щелочи, несколько «кипелок» (кусочков
пемзы), осторожно кипятить смесь на водяной бане.
Незначительный осадок растворится, выделится NH3
(запах, посинение влажной красной лакмусовой
бумажки). Жидкость разделить на две части. К
первой пробе прилить раствор плюмбита натрия (к 1
мл раствора Pb(СН3СОО)2 прибавить по
каплям раствор едкой щелочи до растворения Pb(ОН)2).
Появится желто-бурое или черное окрашивание. Во
вторую пробу прибавить 2–3 капли
свежеприготовленного Na2[Fe(CN)5NO],
возникает красно-фиолетовое окрашивание.
Расщепление щелочью.
В пробирку налить 0,5–1 мл неразбавленного белка,
добавить двойной объем концентрированного
раствора щелочи, несколько «кипелок» (кусочков
пемзы), осторожно кипятить смесь на водяной бане.
Незначительный осадок растворится, выделится NH3
(запах, посинение влажной красной лакмусовой
бумажки). Жидкость разделить на две части. К
первой пробе прилить раствор плюмбита натрия (к 1
мл раствора Pb(СН3СОО)2 прибавить по
каплям раствор едкой щелочи до растворения Pb(ОН)2).
Появится желто-бурое или черное окрашивание. Во
вторую пробу прибавить 2–3 капли
свежеприготовленного Na2[Fe(CN)5NO],
возникает красно-фиолетовое окрашивание.
При действии едких щелочей белки подвергаются
частичному гидролизу. Одновременно происходит
отщепление аминогрупп с образованием NH3.
При наличии в белке остатков цистина или
цистеина из них отщепляется ион S2–,
обнаруживаемый с помощью Pb2+:

(Нитропруссид натрия – реактив на S2–.)
| Порядок
работы |
Задания |
Наблюдения
и
выводы |
| Белок
куриного
яйца после отделения от желтка хорошо взбить,
затем смешать в колбе (встряхивая) с 10–12-кратным
объемом дистиллированной воды, отфильтровать
через двойной слой марли в воронке, отделить
осадок яичного глобулина. Внимательно
рассмотреть фильтрат – раствор альбумина |
Что
собой
представляет водный раствор белка? Ответ
обосновать и подтвердить на практике |
… |
| В
пять пробирок
налить по 2 мл раствора белка. Содержимое первой
пробирки нагреть. Во вторую пробирку добавить 1
каплю 1%-го раствора СН3СООН, нагреть.
Добавить в третью пробирку 0,5 мл 10%-го раствора CH3COOH,
нагреть. В четвертую пробирку добавить 0,5 мл 10%-го
раствора CH3COOH и несколько капель раствора
NaCl, нагреть. В пятую пробирку добавить 0,5 мл
раствора NaOH, нагреть |
Что
происходит
с белком при нагревании? Kак влияет на процесс
изменение среды раствора? Сопоставить
наблюдения, сделать вывод |
… |
| В
пять пробирок
последовательно налить по 0,5 мл исследуемого
раствора белка. В три пробирки из пипетки по
стенкам осторожно прибавить по 1–2 мл
концентрированных кислот H2SO4, HCl, HNO3.
В две остальные пробирки прибавить органические
кислоты: в одну – несколько капель раствора
трихлоруксусной кислоты, в другую –
5-сульфосалициловой кислоты |
Сравнить
результаты опытного исследования действия на
белки минеральных и органических кислот,
объяснить наблюдаемые изменения |
… |
… |
Проверить
яичный альбумин ксантопротеиновой и биуретовой
реакциями. Провести пробу на слабосвязанную
серу. Сделать вывод о присутствии функциональных
групп в составе альбумина. В графе «Порядок
работы» краткой схемой указать ход цветных
реакций белков |
|
|

