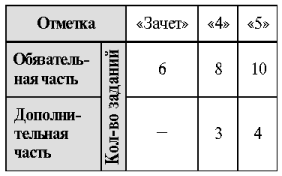
Тесты составлены в четырех вариантах, в каждом
– 16 заданий. Тестовые задания с выборочным типом
ответа предполагают обязательное наличие в
каждом наборе ответов лишь одного правильного.
Задания
Вариант 1
1. Выберите химическое явление:
а) покраснение плодов осенью;
б) растворение сахара в воде;
в) плавление свинца;
г) испарение сухого льда.
2. Разделить смесь речного песка и поваренной
соли можно:
а) с помощью магнита;
б) нагревая смесь;
в) добавив воду и профильтровав раствор;
г) механически разделяя частицы.
3. Является веществом:
а) капля воды;
б) медный провод;
в) кусочек сахара;
г) железо.
4. Выберите формулу простого вещества:
а) К2О;
б) N2;
в) СuSO4;
г) Н2S.
5. Запись 5Н2 обозначает:
а) 5 атомов водорода;
б) 10 атомов водорода;
в) 5 молекул;
г) 5 молекул водорода.
6. В записи 7SO2 коэффициент равен:
а) 7;
б) 14;
в) 2;
г) коэффициент отсутствует.
7. Относительная масса молекулы SO3 равна:
а) 32;
б) 80;
в) 64;
г) 48.
8. Процентное содержание цинка в оксиде цинка ZnO
равно:
а) 50;
б) 20;
в) 10;
г) 80.
9. Валентность хрома в соединении СrО3
равна:
а) 2;
б) 3;
в) 4;
г) 6.
10. Коэффициентами уравнения
...Р + ...О2 = ...Р2О5 являются:
а) 2, 3, 5;
б) 4, 5, 2;
в) 2, 5, 4;
г) 2, 2, 6.
11. Вычислите массу (в г) натрия, вступившего в
реакцию с 64 г серы:
2Na + S = Nа2S.
а) 9,2;
6) 23;
в) 46;
г) 92.
Дополнительная часть
12. Выберите формулу вещества, состоящего из
двух атомов калия, атома кремния и трех атомов
кислорода:
а) СаSiO3;
б) К2SiO3;
в) К2СО3;
г) СаСО3.
13. Формула вещества, состоящего из 64% N и 36% О:
а) N2O;
б) NO;
в) N2O3;
г) NO2.
14. Дополните уравнение
... + ... = 2СuО.
а) Сu и Р;
б) Nа и О2;
в) Сu и О2;
г) 2Cu и О2.
15. Cколько граммов оксида кальция (СаО)
получится при разложении 200 г СаСО3:
СаСО3 = СаО + СО2?
а) 56;
б) 28;
в) 112;
г) 140.
16. Сколько молей содержится в 64 г кислорода О2?
а) 1;
б) 2;
в) 3;
г) 0,1.
Вариант 2
1. Выберите физическое явление:
а) горение магния;
б) «гашение» соды уксусом;
в) растворение краски в воде;
г) подгорание пищи.
2. Отличить сахарный песок от поваренной соли
можно:
а) по цвету;
б) по запаху;
в) по агрегатному состоянию;
г) по вкусу.
3. Является телом:
а) железо;
б) медь;
в) кристалл аметиста;
г) кварц.
4. Выберите формулу сложного вещества:
а) К;
б) N2;
в) Сu;
г) Н2SO4.
5. Запись 5H2O обозначает:
а) 5 атомов водорода;
б) 10 атомов водорода и 5 атомов кислорода;
в) 5 молекул воды;
г) 10 атомов водорода и 1 атом кислорода.
6. В записи 6Н2SO4 индексами являются:
а) 6, 2, 4;
б) 6 и 4;
в) 2 и 4;
г) 12 и 24.
7. Масса (в г) 2 моль воды Н2О равна:
а) 36;
б) 18;
в) 64;
г) 48.
8. Процентное содержание меди в оксиде меди(II)
СuО равно:
а) 5;
б) 25;
в) 40;
г) 80.
9. Валентность железа в соединении Fe2O3
равна:
а) 2;
б) 3;
в) 4;
г) 6.
10. Коэффициентами уравнения
...Аl + ...O2 = ...Аl2О3 являются:
а) 2, 3, 1;
б) 1, 2, 3;
в) 4, 3, 2;
г) 3, 4, 6.
11. Вычислите массу (в г) воды, полученной при
взаимодействии водорода с 1,6 г кислорода:
2Н2 + О2 = 2Н2О.
а) 4,6;
б) 18;
в) 3,2;
г) 1,8.
Дополнительная часть
12. Вещество Аl2(SO4)3 состоит из
... атомов алюминия, ... атомов серы, ... атомов
кислорода.
а) 2, 1, 4;
б) 2, 3, 3;
в) 2, 4, 12;
г) 2, 3, 12.
13. Формула вещества, состоящего из 75% С и 25% Н:
а) СН4;
б) С2Н2;
в) С2Н4;
г) С6Н6.
14. Дополните уравнение
... + 2НСl = ZnCl2 + ... .
а) Zn и Cl2;
б) H2 и Cl2;
в) Zn и Н2;
г) 2Zn и Н2O.
15. Сколько граммов водорода потребуется для
восстановления меди из 160 г ее оксида:
СuO + Н2 = Сu + Н2O?
а) 16;
б) 8;
в) 2;
г) 4.
16. Сколько атомов серы содержится в 2 моль
вещества?
а) 6,02•1023;
б) 12,04•1023;
в) 18,06•1023;
г) 24,08•1023.
Вариант 3
1. Выберите физическое явление:
а) растворение цинка в кислоте;
б) горение дров в костре;
в) таяние льда;
г) разложение перманганата калия при нагревании.
2. Химическое свойство кислорода:
а) газ без цвета и запаха;
б) плохо растворим в воде;
в) не проводит электрический ток;
г) поддерживает горение.
3. Является телом:
а) сахар;
б) золотой слиток;
в) алмаз;
г) сера.
4. Выберите формулу сложного вещества:
а) С (алмаз);
б) Na;
в) СuО;
г) S.
5. Запись К2О обозначает:
а) 1 молекула вещества;
б) 2 атома калия и атом кислорода;
в) 3 атома;
г) 1 атом калия и 2 атома кислорода.
6. В записи 10НNO3 индексами являются:
а) 10;
б) 10 и 3;
в) 10 и 30;
г) 3.
7. Масса (в г) 3 моль кислорода (О2) равна:
а) 96;
б) 18;
в) 64;
г) 48.
8. Процентное содержание азота в оксиде азота(IV)
NО2 равно:
а) 50;
б) 25;
в) 70;
г) 30.
9. Валентность хлора в соединении Сl2O7
равна:
а) 2;
б) 7;
в) 14;
г) 6.
10. Коэффициентами уравнения
...К + ...О2 = ...К2О являются:
а) 4, 0, 2;
б) 1, 2, 4;
в) 4, 1, 2;
г) 4, 4, 6.
11. Вычислите массу (в г) метана (СН4),
полученного при взаимодействии водорода с 24 г
углерода:
2Н2 + С = СН4.
а) 24;
б) 8;
в) 32;
г) 12.
Дополнительная часть
12. Вещество Са3(РО4)2 состоит из
... атомов кальция, ... атомов фосфора, ... атомов
кислорода.
а) 3, 2, 2;
б) 3, 2, 8;
в) 3, 1, 8;
г) 2, 3, 8.
13. Формула вещества, состоящего из 76% Сr и 24% О:
а) CrО;
б) СrО3;
в) Сr2O3;
г) СrCl2.
14. Дополните уравнение
... + ... = Вa3N2.
а) Ва и N2;
б) 3Ва и Н2;
в) 3Ва и N2;
г) 3Ва и N2О.
15. Сколько граммов водорода выделится при
взаимодействии 130 г цинка с соляной кислотой:
Zn + 2HCl = ZnCl2 + H2?
а) 16;
б) 8;
в) 2;
г) 4.
16. Сколько атомов серы содержится в 32 г
вещества?
а) 6,02•1023;
б) 12,04•1023;
в) 18,06•1023; г) 24,08•1023.
Вариант 4
1. Выберите химическое явление:
а) кипение воды;
б) разложение воды;
в) замерзание воды;
г) испарение воды.
2. Разделить смесь можно, потому что свойства
веществ в смеси:
а) не сохраняются;
б) одинаковы;
в) различны и сохраняются;
г) не допускают ее разделения.
3. Является веществом:
а) речная вода;
б) медный колокол;
в) кусочек мела;
г) дистиллированная вода.
4. Выберите формулу простого вещества:
а) K2СО3;
б) N2О;
в) SO3;
г) Н2.
5. Запись 3N2 обозначает:
а) 6 атомов натрия;
б) 6 атомов азота;
в) 3 молекулы натрия;
г) 3 молекулы азота.
6. В записи 12SiO2 коэффициент равен:
а) 24;
б) 14;
в) 2;
г) 12.
7. Относительная масса молекулы NО2 равна:
а) 46;
б) 30;
в) 15;
г) 24.
8. Процентное содержание углерода в этилене (С2Н4)
равно:
а) 70;
б) 22;
в) 43;
г) 86.
9. Валентность серы в соединении SO2 равна:
а) 2;
б) 3;
в) 4;
г) 6.
10. Коэффициентами уравнения
...Аl + ...Сl2 = ...АlCl3 являются:
а) 2, 3, 5;
б) 4, 5, 2;
в) 2, 5, 4;
г) 2, 3, 2.
11. Вычислите массу (в г) серы, вступившей в
реакцию с 16 г кислорода:
S + О2 = SO2.
а) 32;
б) 16;
в) 1,6;
г) 3,2.
Дополнительная часть
12. Выберите формулу вещества, состоящего из
трех атомов натрия, атома фосфора и четырех
атомов кислорода.
а) Na3PO4;
б) К3РО4;
в) NO, Na и Р2О5;
г) NaNO3.
13. Формула вещества, состоящего из 89% Сu и 11% О:
а) Cu2O;
б) СuО;
в) CuSO4;
г) Сu(ОН)2.
14. Дополните уравнение
... + ... = 2Fe2O3.
а) Fe + 6O;
б) 4Fe и 3O2;
в) 4Fе и 6О2;
г) 2Fe и О2.
15. Сколько граммов кислорода получится при
разложении 15,8 г перманганата калия:
2КМnO4 = К2МnO4 + МnO2 + О2?
а) 1,6;
б) 28;
в) 32;
г) 16.
16. Cколько молей составляют 12,04•1023
молекул углекислого газа (СО2)?
а) 1;
б) 2;
в) 3;
г) 0,1.
| 
