Перечень теоретических вопросов
1. Водород – самый распространенный
элемент ... .
2. В условиях звезд и межзвездного
пространства водород существует в виде ... .
3. На Земле практически весь водород
находится в виде ... .
4. Важнейшее соединение водорода – ... .
5. Соединения водорода с металлами
называются ... ; с неметаллами – ... , например
сероводород.
6. Знак водорода – ... , атомная масса –
... , валентность в соединениях – ... .
7. Молекула водорода состоит из ...
атомов.
8. При обычных условиях водород – это
... без ... , ... (тяжелее, легче) воздуха ... , растворим
в воде. Водород имеет низкую температуру кипения.
Только у гелия температура кипения ниже, чем у
водорода.
9. В промышленности водород получают
при взаимодействии ... .
10. В лаборатории водород обычно
получают при взаимодействии растворов кислот
(кроме азотной) с металлами, стоящими в ряду
активности металлов ... водорода. Обычно в
лаборатории водород получают при взаимодействии
соляной кислоты (НСl) и цинка (Zn).
11. Водород собирают способами
вытеснения ... и ... .
12. Водород собирают способом
вытеснения ... , потому что водород малорастворим
в ... .
13. При собирании водорода способом
вытеснения ... пробирку держат ... дном, потому что
водород ... воздуха.
14. Перед работой с водородом его
следует проверить на чистоту, потому что смеси
водорода с кислородом (или воздухом) ... . Особенно
опасен «гремучий газ» – смесь кислорода и
водорода в отношении ... к ... (см. по коэффициентам
реакции горения водорода).
15. При обычных условиях водород
реагирует только с ... металлами, например с
кальцием, и единственным неметаллом – ... .
16. При нагревании или освещении
водород реагирует с большинством металлов и
неметаллов, образуя гидриды – соединения с ... , в
формуле которых знак водорода пишут последним, и
элементоводороды – соединения с ... , в формуле
которых знак водорода пишут первым, при этом ...
проявляет низшую валентность (8 минус № группы).
17. Важнейшим химическим свойством
водорода является его ... способность. Он может
«отнимать» кислород от некоторых оксидов.
Водород при этом является ... . Эту реакцию
используют в промышленности для получения
некоторых чистых металлов.
18. Применение водорода основано на
некоторых его физических и химических свойствах:
легкость – ... ; ... – охлаждающий агент, в
сверхпроводниковой технике, большое количество
теплоты при горении в кислороде – ... ; ... – в
химической отрасли промышленности для получения
... , ... , ... , ... , в нефтесинтезе, для ... и ... металлов.
Подготовка к зачету
1. Речь идет о простом веществе
водород:
а) входит в состав живых организмов;
б) водород восстанавливает металлы из их оксидов;
в) в молекуле гидрида кальция содержится два
атома водорода;
г) основной элемент Вселенной.
2. Самый легкий газ:
а) NO;
б) Н2;
в) СО2;
г) О2.
3. В лаборатории водород получают при
взаимодействии соляной кислоты с:
а) Pt;
б) Cu;
в) Au;
г) Zn.
4. Когда водород собирают способом
вытеснения воздуха, то сосуд держат:
а) вверх дном;
б) вниз дном;
в) горизонтально;
г) не имеет значения.
5. «Гремучий газ» – смесь водорода с
кислородом в соотношении:
а) 2:1;
б) 1:1;
в) 1:2;
г) произвольном.
6. Массовая доля водорода в
хлороводороде (НCl) равна:
а) 0,361;
б) 0,027;
в) 0,043;
г) 0,154.
7. Реагирует с водородом при обычных
температурах:
а) О2;
б) Cl2;
в) S;
г) Ca.
8. Уравнение реакции и название
продукта верны для:
а) N2 + 3H2 = 2NH3, гидрид азота;
б) Ti + H2 = TiH2, оксид титана;
в) Н2 + 2К = 2КН, гидрид калия;
г) Н2 + S = H2S, гидрид серы.
9. Относится к реакции восстановления:
а) FeО + Н2 = Fe + Н2О;
б) Zn + Cl2 = ZnCl2;
в) Zn + S = ZnS;
г) 4Р + 5О2 = 2Р2О5.
10. Реактивами в цепочке превращений
Fe 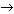 Fe2О3 Fe2О3
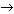 Fe Fe
являются:
а) Н2 и О2;
б) О2 и Н2;
в) Н2О и Н2;
г) О и Н.
11. Выберите формулу гидрида калия:
а) KOH;
б) КNO3;
в) КH;
г) К2SO4.
ДОПОЛНИТЕЛЬНАЯ ЧАСТЬ
12. Имеет самую низкую температуру
кипения:
а) О2;
б) Н2;
в) N2;
г) Сl2.
13. По термохимическому уравнению
2Н2 + О2 = 2Н2О + 571 кДж
рассчитайте (в кДж) количество теплоты,
выделившееся при сгорании 1 г Н2.
а) 2855;
б) 57,10;
в) 142,75;
г) 34,26.
14. Сколько граммов калия прореагирует
с 8 г водорода?
а) 312;
б) 420;
в) 180;
г) 260.
15. Водород в лаборатории получают при
действии кислот на некоторые металлы. При этом
атомы водорода в кислотах замещаются атомами
металлов. Напишите уравнения взаимодействия
водных растворов соляной (НСl) и серной (Н2SO4)
кислот с алюминием и железом(II).
16. В двух одинаковых стеклянных колбах
без этикеток находятся кислород и водород.
Определите, в какой колбе какой газ находится.
Задания зачета 3
Вариант 1
1. Речь идет о простом веществе
водород:
а) входит в состав кислот;
б) чистый водород спокойно горит;
в) в молекуле гидрида кальция содержится два
атома водорода;
г) основной элемент Вселенной.
2. Самый легкий газ:
а) Не;
б) Н2;
в) СО2;
г) О2.
3. В лаборатории водород получают при
взаимодействии кислоты с:
а) Cu;
б) Ag;
в) Zn;
г) Pt.
4. Водород собирают способом
вытеснения:
а) воздуха, держа сосуд горизонтально;
б) воздуха, держа сосуд вниз дном;
в) воды, держа сосуд вниз дном;
г) воды, держа сосуд вверх дном.
5. «Гремучий газ» – смесь водорода с
кислородом в соотношении:
а) 2:1;
б) 1:1;
в) 1:2;
г) произвольном.
6. Массовая доля водорода в воде равна:
а) 0,6;
б) 0,5;
в) 0,4;
г) 0,1.
7. Реагирует с водородом при обычных
температурах:
а) О2;
б) Cl2;
в) S;
г) F2.
8. Уравнение реакции и название
продукта верны для:
а) N2 + 3H2 = 2NH3, азотоводород
(аммиак);
б) Ti + H2 = TiH2, оксид титана;
в) Н2 + О2 = Н2О, вода;
г) Н2 + S = H2S, гидрид серы.
9. Относится к реакции восстановления:
а) СuО + Н2 = Сu + Н2О;
б) Zn + 2HCl = ZnCl2 + H2;
в) Zn + S = ZnS;
г) 4Р + 5О2 = 2Р2О5.
10. Реактивами в цепочке превращений
Сu 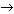 СuО СuО 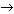 Сu Сu
являются:
а) Н2 и О2;
б) О2 и Н2;
в) Н2О и Н2;
г) О и Н.
11. Выберите формулу гидрида натрия:
а) Nа2O;
б) NаOН;
в) NaH;
г) Na2SO4.
ДОПОЛНИТЕЛЬНАЯ ЧАСТЬ
12. Имеет самую низкую температуру
кипения:
а) О2;
б) Н2;
в) N2;
г) Не.
13. По термохимическому уравнению
2Н2 + О2 = 2Н2О + 571 кДж
рассчитайте (в кДж) количество теплоты,
выделившееся при сгорании 10 г Н2.
а) 2855;
б) 5710;
в) 1427,5;
г) 3426.
14. Сколько граммов кальция
прореагирует с 4 г водорода?
а) 20;
б) 40;
в) 80;
г) 160.
15. Водород в лаборатории получают при
действии кислот на некоторые металлы. При этом
атомы водорода в кислотах замещаются атомами
металлов. Напишите уравнения взаимодействия
соляной (НСl) и серной (Н2SO4) кислот с
алюминием и цинком.
16. В двух стеклянных колбах без
этикеток находятся кислород и водород.
Определите, в какой колбе какой газ находится.
Вариант 2
1. Речь идет об элементе водород:
а) при обычных температурах реагирует с Са и F2;
б) чистый водород спокойно горит;
в) его смеси с кислородом взрывоопасны;
г) первый по распространенности во Вселенной.
2. Валентность и относительная атомная
масса водорода равны:
а) 1 и 2;
б) 2 и 2;
в) 1 и 1;
г) 1 и 1,5.
3. В лаборатории водород получают при
взаимодействии кислоты с:
а) Hg;
б) Ag;
в) Mg;
г) Аu.
4. Когда водород собирают способом
вытеснения воздуха, сосуд держат:
а) горизонтально;
б) вниз дном;
в) вверх дном;
г) не имеет значения.
5. Чистый водород горит в избытке
кислорода:
а) со свистом;
б) со взрывом;
в) без звука;
г) не горит.
6. Массовая доля водорода в аммиаке NH3
равна:
а) 0,36;
б) 0,18;
в) 0,42;
г) 0,25.
7. Реагирует с водородом при обычных
температурах:
а) N2;
б) Cl2;
в) Ca;
г) Fе.
8. Уравнение реакции и название
продукта верны для:
а) 2Nа + H2 = 2NaH, натрийводород;
б) F2 + H2 = 2HF, фтороводород;
в) Н2 + Сl2 = 2НCl, оксид хлора;
г) Н2 + Sе = H2Sе, гидрид селена.
9. Относится к реакции восстановления:
а) Сa + Н2 = СaН2;
б) Zn + 2HBr = ZnBr2 + H2;
в) 2H2 + O2 = 2H2O;
г) Fe2O3 + 3H2 = 3H2О + 2Fe.
10. Реактивами в цепочке превращений
W 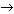 WО3 WО3 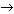 W W
являются:
а) Н2O и О2;
б) Н2О и Н2;
в) О2 и Н2;
г) Н и О.
11. Выберите формулу сероводорода:
а) Nа2S;
б) SO2;
в) H2S;
г) Н2SO4.
ДОПОЛНИТЕЛЬНАЯ ЧАСТЬ
12. Имеет самую высокую
теплопроводность:
а) СО2;
б) N2;
в) Не;
г) Н2.
13. По термохимическому уравнению
СuО + Н2 = Сu + Н2О + 80 кДж
рассчитайте массу (в г) водорода, если
выделилось 400 кДж теплоты.
а) 20;
б) 5;
в) 80;
г) 10.
14. Какой объем водорода (в л)
прореагирует с 4 г кальция (н. у.)?
а) 2,24;
б) 2240;
в) 4,48;
г) 1,12.
15. Водород в лаборатории получают при
действии кислот на некоторые металлы. При этом
атомы водорода в кислотах замещаются атомами
металлов. Напишите уравнения взаимодействия
бромоводородной (НBr) и серной (Н2SO4)
кислот с магнием и железом(III).
16. В двух стеклянных колбах без
этикеток находятся углекислый газ и водород.
Определите, в какой колбе какой газ находится.
Вариант 3
1. Речь идет о простом веществе
водород:
а) используют в метеорологических зондах;
б) образует соединения с неметаллами;
в) его валентность равна единице;
г) входит в состав веществ, содержащихся в живых
организмах.
2. Водород – самый распространенный
элемент:
а) на Земле;
б) в живых организмах;
в) звезд и межзвездного газа;
г) на Луне.
3. В лаборатории водород нельзя
получить при взаимодействии кислоты с:
а) К;
б) Al;
в) Нg;
г) Са.
4. Основной промышленный способ
получения водорода:
а) СН4 + 2Н2О = СО2 + 4Н2;
б) 2Н2О = 2Н2 + О2;
в) Zn + 2HCl = ZnCl2 + H2;
г) из воздуха путем его сжижения.
5. Водород собирают способом
вытеснения воздуха, поскольку:
а) он хорошо растворим в воде;
б) он легче воздуха;
в) он тяжелее воздуха;
г) он плохо растворим в воде.
6. Массовая доля водорода в гидриде
лития LiH равна:
а) 0,365;
б) 0,125;
в) 0,412;
г) 0,250.
7. Не реагирует с водородом при обычных
температурах:
а) Li;
б) Ca;
в) F2;
г) S.
8. Уравнение реакции и название
продукта верны для:
а) Si + 2H2 = SiH4, кремнийводород (силан);
б) Li + H2 = LiH2, гидрид лития;
в) Н2 + 2К = 2КН, оксид калия;
г) 3Н2 + 2Р = 2РН3, кальцийводород.
9. Относится к реакции восстановления:
а) Н2S = Н2 + S;
б) TiO2 + 2H2 = 2H2О + Ti;
в) 2H2 + C = CH4;
г) Mg + 2HCl = MgCl2 + H2.
10. Реактивами в цепочке превращений
Рb 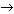 РbО РbО 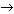 Рb Рb
являются:
а) Н2 и O2;
б) Н2О и Н2;
в) Н2O и О2;
г) О2 и Н2.
11. Выберите формулу гидрида кальция:
а) СаН2;
б) CаO;
в) Са(ОH)2;
г) КН.
ДОПОЛНИТЕЛЬНАЯ ЧАСТЬ
12. Для получения водорода используют
химические методы, т. к. водород:
а) существует на Земле в свободном виде;
б) существует на Земле в виде соединений;
в) легкий газ;
г) молекулы водорода прочны.
13. По термохимическому уравнению
СН4 + 2Н2О = СО2 + 4Н2 – 165
кДж
рассчитайте массу (в г) водорода, если затрачено
16,5 кДж теплоты:
а) 0,8;
б) 1,4;
в) 5;
г) 7 г.
14. Какой объем водорода (в л)
прореагирует с 16 г кислорода (н. у.)?
а) 22,4;
б) 67,2;
в) 44,8;
г) 11,2.
15. Водород в лаборатории получают при
действии кислот на некоторые металлы. При этом
атомы водорода в кислотах замещаются атомами
металлов. Напишите уравнения взаимодействия
йодоводородной (НI) и фосфорной (Н3РO4)
кислот с калием и цинком.
16. В двух стеклянных колбах без
этикеток находятся озон и водород. Определите, в
какой колбе какой газ находится.
Вариант 4
1. Речь идет об элементе водород:
а) жидкий водород используют для получения
сверхнизких температур;
б) малорастворим;
в) с металлами образует соединения – гидриды;
г) молекулы водорода достаточно прочны.
2. Атомная масса водорода ... атомной
массы кислорода:
а) больше в 4 раза;
б) меньше в 16 раз;
в) меньше на 6;
г) меньше в 8 раз.
3. В лаборатории водород нельзя
получить при взаимодействии кислоты с:
а) К;
б) Ag;
в) Mg;
г) Ва.
4. Водород собирают способом
вытеснения воды, потому что он:
а) легче воздуха;
б) хорошо растворим в воде;
в) взаимодействует с водой;
г) плохо растворим в воде.
5. Водород перед работой с ним
проверяют на чистоту, поскольку:
а) он горит в избытке кислорода;
б) с ним «летят» пары кислоты, вредные для
здоровья;
в) он содержит пары воды;
г) его смесь с воздухом взрывоопасна.
6. Массовая доля водорода в метане СH4
равна:
а) 0,36;
б) 0,18;
в) 0,42;
г) 0,25.
7. Не реагирует с водородом при обычных
температурах:
а) Nа;
б) Cl2;
в) Ca;
г) F2.
8. Уравнение реакции и название
продукта верны для:
а) С + 2H2 = СH4, углеводород (метан);
б) К + H2 = КH2, гидрид калия;
в) Н2 + I2 = 2НI, оксид йода;
г) Н2 + Са = СаH2, кальцийводород.
9. Относится к реакции восстановления:
а) 2Н2O = 2Н2 + O2;
б) Fe + 2HCl = FeCl2 + H2;
в) 3H2 + 2P = 2PH3;
г) Аl2O3 + 3H2 = 3H2О + 2Al.
10. Реактивами в цепочке превращений
Fe 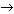 Fe3О4 Fe3О4
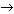 Fe Fe
являются:
а) Н2 и O2;
б) Н2О и Н2;
в) Н2O и О2;
г) О2 и Н2.
11. Выберите формулу хлороводорода:
а) КСl;
б) Cl2O7;
в) HCl;
г) НClO4.
ДОПОЛНИТЕЛЬНАЯ ЧАСТЬ
12. На Земле практически весь водород
находится в виде:
а) свободном;
б) отдельных атомов;
в) соединений;
г) молекул.
13. По термохимическому уравнению
СuО + Н2 = Сu + Н2О + 80 кДж
рассчитайте число моль водорода, если
выделилось 560 кДж теплоты.
а) 2;
б) 14;
в) 5;
г) 7.
14. Какой объем водорода (в л)
прореагирует с 14 г азота N2 (н. у.)?
а) 22,4;
б) 2240;
в) 44,8;
г) 33,6.
15. Водород в лаборатории получают при
действии кислот на некоторые металлы. При этом
атомы водорода в кислотах замещаются атомами
металлов. Напишите уравнения взаимодействия
сероводородной (Н2S) и фосфорной (Н3РO4)
кислот с натрием и магнием.
16. В двух стеклянных колбах без
этикеток находятся азот и водород. Определите, в
какой колбе какой газ находится.
Критерии оценки ответов на задания зачета
| Отметка |
«Зачет» |
«4» |
«5» |
Обязательная
часть |
Кол-во
заданий |
6 |
8 |
10 |
Дополнительная
часть |
– |
3 |
4 |
| 
