ВАРИАНТ 1
1. Среди химических элементов Si, Р, S,
Cl более ярко свойства неметалла выражены у:
1) кремния; 2) фосфора; 3) серы; 4) хлора.
2. Атомы элементов, имеющие одинаковое число
валентных электронов, расположены:
1) в одной группе; 2) в одной подгруппе;
3) в одном периоде; 4) по диагонали.
3. В оксидах элементов третьего периода
периодической системы – Na2О, МgО, Al2O3,
SiO2, P2O5, SO3, Cl2O7
– в периоде слева направо:
1) осно'вные свойства возрастают;
2) осно'вные свойства неизменны;
3) кислотные свойства усиливаются;
4) кислотные свойства уменьшаются.
4. Число протонов в ядре атома 7Li равно:
1) 3; 2) 4; 3) 6; 4) 7.
5. Изотопы химического элемента отличаются
числом:
1) нейтронов;
2) заполненных электронных слоев;
3) валентных электронов;
4) протонов.
6. Химическому элементу, степень окисления
которого в соединении равна –2, соответствует
схема распределения электронов в атоме по слоям:
1) 2, 8, 6; 2) 2, 8, 2; 3) 2, 8, 7; 4) 2, 2.
7. Разрушение химической связи – это
процесс, который:
1) сопровождается выделением энергии;
2) происходит самопроизвольно в изолированных
системах;
3) требует затраты энергии;
4) может происходить только под действием света.
8. Вещества, формулы которых – RbF, HF, F2,
образованы химическими связями cоответственно:
1) ковалентной неполярной, ковалентной
полярной, ионной;
2) ионной, ковалентной неполярной, ковалентной
полярной;
3) ионной, ковалентной полярной, ковалентной
неполярной;
4) ковалентной полярной, ионной, ковалентной
неполярной.
9. Высшую и низшую валентность сера
проявляет соответственно в соединениях;
1) SO3 и ZnS; 2) SO2 и H2S;
3) SO3 и SO2; 4) H2S и SO3.
10. Азот имеет степень окисления +3 в ряду
веществ:
1) N2O3, HNO3, KNO2;
2) NH3, N2O3, HNO3;
3) NaNO2, N2O3, HNO2;
4) KNO3, HNO2, NH3.
11. Ионную кристаллическую решетку имеет:
1) фторид натрия; 2) вода;
3) алюминий; 4) алмаз.
12. Высший оксид состава Э2О3
образует химический элемент, имеющий:
1) заряд атомного ядра +3;
2) пять электронов на внешнем электронном слое;
3) заряд атомного ядра +13;
4) два электрона на внешнем электронном слое.
13. Ион, имеющий в своем составе 18 электронов
и 16 протонов, имеет заряд:
1) +1; 2) +2; 3) –1; 4) –2.
14. Атом щелочного металла, который
образует ион с электронной конфигурацией 1s22s22p63s23p6, –
это:
1) рубидий; 2) калий; 3) натрий; 4) литий.
15. Ядро атома 13С состоит из:
1) шести протонов и шести нейтронов;
2) шести нейтронов и семи протонов;
3) шести протонов и восьми нейтронов;
4) семи нейтронов и шести протонов.
16. Химический элемент, в атоме которого
распределение электронов по слоям 2, 8, 5, образует
с водородом химическую связь:
1) ковалентную полярную;
2) ковалентную неполярную;
3) ионную;
4) металлическую. ВАРИАНТ 2 1. Наиболее ярко металлические
свойства выражены у:
1) лития; 2) калия; 3) натрия; 4) рубидия.
2. Атомы азота и фосфора имеют:
1) одинаковое число электронных слоев;
2) одинаковое число электронов внешнего
электронного слоя;
3) одинаковое число протонов в ядре;
4) одинаковые радиусы.
3. Четыре электрона на внешнем
энергетическом уровне имеет атом:
1) гелия; 2) бериллия; 3) углерода; 4) кислорода.
4. В состав ядра атома входят:
1) протоны и электроны;
2) электроны и нейтроны;
3) нейтроны и протоны;
4) только протоны.
5. Изотопы химического элемента имеют
разные массы, потому что в их атомах разное число:
1) протонов; 2) нейтронов;
3) электронов; 4) протонов и нейтронов.
6. В ряду химических элементов С 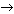 Al Al 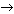 Са число
электронных слоев в их атомах: Са число
электронных слоев в их атомах:
1) возрастает от 3 до 5;
2) возрастает от 2 до 4;
3) уменьшается от 4 до 2;
4) уменьшается от 5 до 3.
7. Образование химической связи – это
процесс, который:
1) сопровождается выделением энергии;
2) происходит самопроизвольно в изолированных
системах;
3) требует затраты энергии.
4) может происходить только под действием света.
8. Вещества с ковалентной неполярной связью:
1) O3, N2, H2, O2; 2) O2, O3,
CO, NH3;
3) NH3, CO, CO2, H2O; 4) H2O, O2,
N2, H2.
9. Валентности металлов в соединениях Al2O3,
AgCl, FeCl2 равны соответственно:
1) III, II, I; 2) I, II, III; 3) II, I, I; 4) III, I, II.
10. Степень окисления серы одинакова в ряду
веществ:
1) CuSO4, Cu2S, H2SO4;
2) SO2, (NH4)2SO4, H2SO4;
3) SO3, H2SO3, Na2SO3;
4) K2SO3, SO2, Na2SO3.
11. Кристаллическая решетка твердого оксида
углерода(IV) СО2:
1) ионная; 2) атомная;
3) молекулярная; 4) металлическая.
12. Химическому элементу со степенью
окисления –3 соответствует распределение
электронов в атоме по слоям:
1) 2, 8, 7; 2) 2, 3; 3) 2, 5; 4) 2, 8, 2.
13. Ион, имеющий в своем составе 18 электронов
и 17 протонов, имеет заряд:
1) +2; 2) +1; 3) –1; 4) –2.
14. Атом галогена, образующий ион с
электронной конфигурацией 1s22s22p63s23p6,
– это:
1) фтор; 2) хлор; 3) бром; 4) йод.
15. Ядро атома 3Не состоит из:
1) трех протонов;
2) двух протонов и одного нейтрона;
3) двух протонов и одного электрона;
4) трех нейтронов и одного протона.
16. В соединении фтора с элементом, в атоме
которого распределение электронов по слоям 2, 8, 8,
1, химическая связь:
1) ионная;
2) ковалентная полярная;
3) ковалентная неполярная;
4) металлическая.
Ответы на задания теста
В а р и а н т 1. 1 – 4; 2 – 2; 3 – 3; 4
– 1; 5 – 1; 6 – 1; 7 – 3; 8 – 3; 9 – 1; 10
– 3; 11 – 1; 12 – 3;
13
– 4; 14 – 2; 15 – 4; 16 – 1.
В а р и а н т 2. 1 – 4; 2 – 2; 3 – 3; 4
– 3; 5 – 2; 6 – 2; 7 – 1; 8 – 1; 9 – 4; 10
– 4; 11 – 3; 12 – 3;
13
– 3; 14 – 2; 15 – 2; 16 – 1.
| 
