1. Идеальным называют раствор, в котором:
а) силы межмолекулярного взаимодействия между
компонентами различны;
б) растворение вещества сопровождается тепловым
эффектом;
в) не происходят химические реакции между
компонентами;
г) силы межмолекулярного взаимодействия между
компонентами отсутствуют.
2. Растворы с одинаковым значением
осмотического давления называют:
а) изотоническими;
б) гипотоническими;
в) гипертоническими;
г) осмотическими.
3. К сильным электролитам в водных растворах
принадлежат:
а) растворы хлорида лития и йодида натрия в
ацетоне;
б) основания р-элементов;
в) большинство солей, щелочи;
г) растворы хлорида лития и йодида натрия в
уксусной кислоте.
4. Чем больше константа диссоциации, тем:
а) более диссоциирована кислота;
б) менее диссоциирована кислота;
в) медленнее вещество распадается на ионы при
растворении в воде.
5. Примером амфотерного электролита может
быть:
а) гидроксид цинка;
б) хлорная кислота;
в) хлороводород;
г) калиевая щелочь.
6. Анализ единиц измерений показывает, что 1
Дж/л равен:
а) 1кПа;
б) 1МПа;
в) 100 кПа;
г) 100 МПа.
7. Окраска фенолфталеина в кислом растворе:
а) бесцветная;
б) красная;
в) желтая;
г) малиновая.
8. Степенью диссоциации называют:
а) отношение числа молекул, не диссоциирующих
на ионы, к общему числу молекул растворенного
электролита;
б) отношение числа молекул, диссоциирующих на
ионы, к общему числу молекул растворенного
электролита;
в) отношение числа молекул, диссоциирующих на
ионы, к числу недиссоциированных молекул
растворенного электролита;
г) единичную концентрацию растворенного
электролита.
9. Выберите верное утверждение:
а) температура замерзания раствора ниже
температуры замерзания чистого растворителя;
б) температура кипения раствора ниже температуры
кипения чистого растворителя;
в) температура замерзания раствора выше
температуры замерзания чистого растворителя;
г) температура кипения раствора равна
температуре кипения чистого растворителя.
10. Объединение одинаковых молекул – это:
а) ассоциация;
б) диссоциация;
в) распад;
г) взаимопревращение.
11. Согласно протонной теории кислот и
оснований Й.Н.Бренстеда:
а) кислоту считают акцептором протонов;
б) основание считают донором протонов;
в) основание считают акцептором протонов;
г) кислота может быть как донором, так и
акцептором протонов.
12. Согласно электронной теории кислот и
оснований Г.Н.Льюиса:
а) кислота является донором электронов;
б) кислота является акцептором электронов;
в) основание является акцептором электронов;
г) основание может быть как акцептором, так и
донором электронов.
13. Электролитическая диссоциация может
произойти в результате:
а) сольватации;
б) химического мономолекулярного превращения;
в) ядерного распада;
г) гипоконъюгации.
14. Степень взаимодействия частиц в растворе
тем выше, чем:
а) меньше плотность их зарядов;
б) больше плотность их зарядов;
в) больше расстояние между ними;
г) больше среднее расстояние между ними.
15. Взятый с обратным знаком десятичный
логарифм активности (концентрации) ионов
водорода в растворе – это:
а) индикаторный показатель;
б) водородный показатель;
в) температурный показатель;
г) объемный показатель.
16. Окраска фенолфталеина в щелочном
растворе:
а) малиновая;
б) желтая;
в) синяя;
г) бесцветная.
17. Окраска лакмуса в кислом растворе:
а) малиновая;
б) желтая;
в) синяя;
г) красная.
18. Окраска лакмуса в щелочном растворе:
а) синяя;
б) красная;
в) бесцветная;
г) желтая.
19. Растворы, в которых водородный
показатель относительно мало изменяется при
добавлении небольших количеств кислоты или
основания, называют:
а) гипертоническими;
б) гипотоническими;
в) буферными;
г) коллигативными.
20. Реакции обмена между водой и
растворенными в ней солями называют:
а) гидролизом оснований;
б) гидролизом солей;
в) сольволизом солей;
г) сольволизом оснований.
21. В выражение для расчета константы
гидролиза ацетата натрия не входит значение
концентрации:
а) [Na+];
б) [CH3COOH];
в) [OH–];
г) [CH3COO–].
22. Характер большинства коллоидных
растворов неорганических веществ:
а) гидрофильный;
б) гидрофобный;
в) амфифильный;
г) амфифобный.
23. Передача электронов атомом, т. е.
повышение степени окисления элемента, – это:
а) восстановление;
б) окисление.
24. Смещение электронов от одного
связываемого химической связью атома к другому,
происходящее с понижением степени окисления
элемента, – это:
а) восстановление;
б) окисление.
25. К типичным восстановителям не относятся:
а) анионы, содержащие атомы с низкой степенью
окисления;
б) анионы, содержащие атомы с высокой степенью
окисления;
в) азотоводороды;
г) бороводороды.
26. К типичным окислителям не относятся:
а) пероксиды;
б) соединения благородных газов;
в) трехвалентный катион железа;
г) бороводороды.
27. Продуктами реакции окисления сульфата
железа(II) перманганатом калия в кислой среде
наряду с сульфатом калия и водой являются:
а) сульфаты марганца(II) и железа(III);
б) сульфаты марганца(III) и железа(III);
в) сульфаты марганца(I) и железа(II);
г) сульфаты марганца(II) и железа(II).
28. Английский ученый, установивший
зависимость между количеством прошедшего через
раствор электричества и количеством вещества,
испытавшим химические превращения на электроде:
а) Дж.К.Максвелл;
б) М.Фарадей;
в) Д.И.Менделеев;
г) Р.Броун.
29. Электролиз – это:
а) процесс превращения электрической энергии в
магнитную;
б) процесс превращения механической энергии в
электрическую;
в) процесс превращения электрической энергии в
химическую;
г) процесс превращения электрической энергии в
механическую.
30. Катод – это:
а) электрод, на котором идет реакция
восстановления;
б) электрод, на котором идет реакция окисления;
в) электрод, который подключен к положительному
полюсу источника тока;
г) электрод, на котором элемент отдает свои
электроны.
31. Разрушение металла в результате его
физико-химического взаимодействия с окружающей
средой – это:
а) электролиз;
б) коррозия;
в) сольволиз;
г) гидролиз.
32. Электрохимическая коррозия не протекает:
а) в водных растворах солей;
б) в сернистой нефти;
в) в почве;
г) в атмосфере любого влажного газа.
33. Химическая коррозия может протекать:
а) в агрессивных органических жидкостях;
б) в морской воде;
в) в растворах кислот;
г) в почве.
34. Пассивностью металла называют:
а) состояние его пониженной коррозионной
устойчивости, вызванное торможением анодного
процесса;
б) состояние его повышенной коррозионной
устойчивости, вызванное активацией анодного
процесса;
в) состояние его пониженной коррозионной
устойчивости, вызванное активацией анодного
процесса;
г) состояние его повышенной коррозионной
устойчивости, вызванное торможением анодного
процесса.
35. Молярностью (молярной концентрацией)
растворов называют:
а) количество вещества в молях, содержащееся в 1
л раствора;
б) количество вещества в молях, содержащееся в 100
мл раствора;
в) массу вещества в граммах, содержащуюся в 1 л
раствора;
г) число молей вещества, содержащееся в 100 л
раствора.
36. Явление селективной диффузии
определенного сорта частиц в растворе через
полупроницаемую перегородку – это:
а) теплообмен;
б) осмос;
в) массоперенос;
г) химическое взаимодействие.
37. Термическая диссоциация протекает:
а) по гетеролитическому механизму;
б) по гомолитическому механизму.
38. В результате гидролиза ацетата натрия:
а) увеличивается концентрация протонов в
растворе;
б) увеличивается концентрация гидроксид-ионов в
растворе;
в) концентрация гидроксид-ионов и протонов в
растворе остается неизменной;
г) реакция не идет.
39. В результате гидролиза хлорида аммония:
а) увеличивается концентрация ионов водорода в
растворе;
б) уменьшается концентрация ионов водорода в
растворе;
в) увеличивается концентрация гидроксид-ионов в
растворе;
г) концентрация ионов водорода и гидроксид-ионов
в растворе остается неизменной.
40. Напишите уравнение реакции 2 моль
перманганата калия и 16 моль соляной кислоты и
подсчитайте количество молей образующегося
молекулярного хлора:
а) 4; б) 5; в) 6; г) 7.
41. Подсчитайте суммарное число молей
продуктов реакции перманганата калия и сульфита
калия в щелочной среде:
а) 4; б) 5; в) 6; г) 7.
42. Краткое ионное уравнение реакции
окисления меди трихлоридом железа имеет вид:
а) Cu + Fe2+ = Сu2+ + Fe2+;
б) Cu + Fe3+ = Cu+ + Fe3+;
в) Cu + 2Fe3+ = Cu2+ + 2Fe2+;
г) Cu + Fe2+ = Cu+ + Fe2+.
43. Размерность константы Фарадея F
следующая:
а) Кл/моль;
б) А/Кл;
в) А/с•Кл;
г) А•с.
44. Если в результате реакции восстановления
Cu2+ на электроде выделилось 63,54 г меди, то
через электрод должно пройти количество
электричества, равное:
а) 193 000 Кл;
б) 195 000 Кл;
в) 194 000 Кл;
г) 194 700 Кл.
45. В гальванических элементах происходят
процессы:
а) превращения химической энергии в
электрическую;
б) превращения химической энергии в магнитную;
в) превращения электрической энергии в
механическую;
г) превращения химической энергии в
механическую.
46. Если в результате реакции 2Н+ + 2е 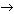 Н2 на электроде при
нормальных условиях выделилось 5,6 л водорода, то
количество электричества, прошедшего через
раствор, равно: Н2 на электроде при
нормальных условиях выделилось 5,6 л водорода, то
количество электричества, прошедшего через
раствор, равно:
а) 49 500 Кл;
б) 48 500 Кл;
в) 48 250 Кл;
г) 49 250Кл.
47. Сумма коэффициентов при продуктах
реакции перманганата и сульфита калия в
сернокислой среде равна:
а) 9; б) 10; в) 11; г) 12.
48. Укажите степень окисления азота в
гидразине NxHy (Mr(NxHy)
= 32):
а) –2; б) +5; в) +3; г) –3.
49. Произведение растворимости не зависит
от:
а) природы растворенного вещества;
б) активности ионов в растворе;
в) природы растворителя;
г) температуры раствора.
50. Растворы, содержащие хлорид-ионы, при
добавлении раствора нитрата серебра дают:
а) белый осадок;
б) желтый осадок;
в) красный осадок;
г) синий осадок.
Ответы на тестовые задания
1 – в; 2 – а; 3 – в; 4 – а; 5 – а; 6
– а; 7 – а; 8 – б; 9 – а; 10 – а; 11 –
в; 12 – б; 13 – а; 14 – б;
15 – б; 16 – а; 17 – г; 18 – а; 19 – в; 20
– б; 21 – а; 22 – б; 23 – б; 24 – а; 25
– б; 26 – г;
27 – а; 28 – б; 29 – в; 30 – а; 31 – б; 32
– б; 33 – а; 34 – г; 35 – а; 36 – б; 37
– б; 38 – б;
39 – а; 40 – б; 41 – а; 42 – в; 43 – а; 44
– а; 45 – а; 46 – в; 47 – в; 48 – а; 49
– б; 50 – а.
Критерии оценки
| Оценка |
«2» |
«3» |
«4» |
«5» |
| Выполнение работы, % |
До 48 |
50–69 |
70–91 |
92–100 |
Кол-во
правильных
ответов |
До 24 |
25–34 |
35–45 |
46–50 |
| 
