1. Какой термин является синонимом слова
«белки»?
1) Пептиды.
2) Пептаны.
3) Протеины.
4) Полипептиды.
2. Какое из следующих положений наиболее полно
и точно характеризует белки?
1) Белки – это вещества, содержащие в своем
составе элементы С, H, O, N и обычно также S и Р.
2) Белки – это высокомолекулярные соединения, в
молекулах которых повторяющиеся группы атомов
связаны пептидной связью.
3) Белки – это высокомолекулярные соединения,
построенные из остатков 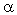 -аминокислот L-ряда. -аминокислот L-ряда.
4) Белки – это высокомолекулярные соединения,
построенные из остатков 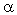 -аминокислот D-ряда. -аминокислот D-ряда.
3. Какое из перечисленных ниже утверждений
в меньшей степени характеризует белки,
являющиеся уникальным субстратом всех форм
жизни на Земле?
1) Белки – это соединения с бесконечным
многообразием структуры и высокой видовой
специфичностью.
2) Белки – это часто соединения с
биокаталитическими свойствами.
3) Белки – это соединения, способные отвечать на
внешние воздействия изменением конфигурации
молекулы и восстанавливать исходное состояние
после прекращения воздействия.
4) Белки – это соединения, способные
образовывать надмолекулярные структуры в
результате реакции с другими веществами.
5) Белки – это соединения, образованные
элементами С, Н, N, O.
4. В результате количественного анализа
одного из веществ (предполагается, что это белок)
было установлено, что массовая доля элемента N
составляет 38%. Выберите наиболее верное
утверждение, характеризующее результаты
анализа.
1) Такой белок существует, если допустить, что он
состоит только из остатков глицина, в котором на
один атом N приходится два атома С, один атом О и
три атома Н, поэтому 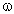 (N) достигает таких значений. (N) достигает таких значений.
2) Массовая доля N достигает таких значений, если
белок образован аспарагином (амид аспарагиновой
кислоты).
3) Это белки, молекулы которых образованы
остатками диаминомонокарбоновых кислот, таких,
как лизин.
4) Белок с таким содержанием N может состоять
только из аргинина. Каждый остаток аргинина в
составе белка содержит четыре атома N.
5) Белки с 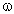 (N) = 38%
в природе отсутствуют. (N) = 38%
в природе отсутствуют.
5. Абиогенные синтезы белков очень сложны,
трудоемки, длительны и дороги. Поэтому
единственным источником белков являются
растения и животные. Но выделить белок – это
нелегкая задача. Какая процедура окажется
непригодной в работе биохимика при выделении
белка из природного материала?
1) Осаждение белка из раствора под действием
соли.
2) Фракционная перегонка смеси белков.
3) Разделение белков методом электрофореза
(метод основан на различной подвижности белковых
молекул в среде под действием электрического
тока).
4) Пропускание раствора смеси белков через
колонку, заполненную силикагелем.
6. Для полного извлечения белков из
биоматериала необходимо разрушение клеточных
оболочек (мембран). Для этих целей используются
различные методы. Какой из перечисленных методов
разрушения клеточных оболочек работает наиболее
«грубо», т.е. приводит к разрушению белковых
молекул?
1) Ультразвук.
2) Многократное замораживание и оттаивание
тканей.
3) Использование гомогенизаторов с острыми,
быстро вращающимися ножами.
4) Растирание объекта с кварцевым песком.
5) Растирание материала между шлифованными
поверхностями.
7. Вам необходимо из измельченной ткани
извлечь нерастворимый белок. Какое действие
оказывается ненужным в данной работе?
1) Высаливание извлекаемого белка.
2) Обработка биоматериала ацетоном или эфиром.
3) Выдерживание биоматериала в термостате в
присутствии амилаз.
4) Использование метода диализа или
электродиализа.
5) Обработка биоматериала растворами фосфатов
лития, калия, глицерина, бутилового спирта
(извлекаемый белок в этих растворах не
растворяется).
8. Через колонку, заполненную зернами
сефадекса (пористый материал-носитель),
пропускали раствор смеси белков. Каково
назначение этого метода и на чем он основан?
1) Метод позволяет разделять белки с разной
молекулярной массой. Первыми пройдут слой
сефадекса белки с малыми размерами молекул.
2) Зерна сефадекса задерживают мелкие молекулы.
Белки с крупными молекулами вместе с
растворителем выйдут из колонки первыми.
3) Сефадекс непроницаем для белковых молекул.
Метод позволяет освободиться только от очень
мелких неорганических ионов (K+, Nа+, Сl–,
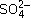 и т. д.). и т. д.).
4) Метод позволяет разделить молекулы с разным
зарядом на их поверхности. Сефадекс работает по
принципу ионнообменной смолы – катионита или
анионита.
5) Это метод электрофореза на твердой опорной
среде, а не метод молекулярных сит.
9. Какой из фрагментов может быть отнесен к
белковой молекуле?
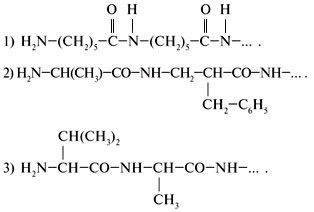
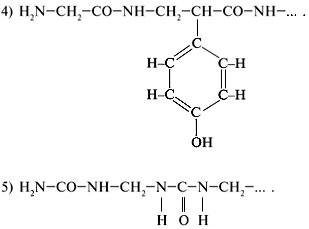
10. Ниже приведены проекционные формулы
аминокислот, отражающие расположение в
пространстве атома Н, NН2-группы и радикала.
Какая аминокислота не является составной частью
подавляющего числа природных белков, т.е. имеет
не L-, а D-конфигурацию?
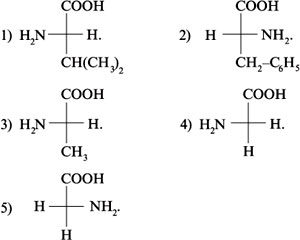
11. Какое утверждение неверно характеризует
строение и свойства радикала R аминокислоты RCH(NH2)COOH?
1) Радикал может быть разного строения и
состава. Это группа атомов, связанная с 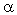 -углеродным атомом
и не участвующая в образовании полипептидной
цепи. -углеродным атомом
и не участвующая в образовании полипептидной
цепи.
2) Порядок чередования радикалов в
полипептидной цепи в конечном счете определяет
пространственную форму белка.
3) Радикалы определяют растворимость белка в
полярных и неполярных молекулах.
4) Радикалы определяют заряд и знак заряда на
поверхности белка.
5) Радикалы определяют основные и кислотные
свойства белка.
6) Радикалы определяют подвижность белковой
молекулы в электрическом поле.
7) Радикал (R) аминокислоты – это группа атомов,
не содержащая амино- и карбоксигруппы.
12. Определите пункт, неверно описывающий
строение и свойства белков.
1) Белки – высокомолекулярные соединения.
Реакции образования белковых молекул относятся
к реакциям поликонденсации.
2) Как и для многих высокомолекулярных
соединений, для белков могут быть заданы только
средние молекулярные массы, т.е. любой белок
представлен смесью фракций с разной
молекулярной массой, как полиэтилен,
полипропилен и другие синтетические полимеры.
3) Изоэлектрическая точка белка – это рН среды,
при котором молекулы белка в электрическом поле
неподвижны.
4) В белке сальмина из молок семги массовая доля
аргинина (после гидролиза) составляет 85,2%, серина
– 9,1%. При электрофорезе в слабокислой среде
молекулы сальмина перемещаются к катоду.
5) Фермент желудочного сока пепсин содержит 11,34%
глутаминовой и 16,63% аспарагиновой кислот (по
массе). Аргинин, лизин, гистидин в сумме
составляют не более 2%. В электрическом поле при
электрофорезе молекулы пепсина перемещаются к
аноду.
13. Какое вещество из следующего перечня не
является белком?
1) Гемоцианин.
2) Актин.
3) Адреналин.
4) Фиброин.
5) Кератин.
6) Каталаза.
7) Амилаза.
8) Химотрипсин.
9) Лизоцим.
10) Казеин.
11) Инсулин.
14. Трипептид образован остатками трех
аминокислот – глицина, серина, гистидина.
Сколько трипептидов могут иметь такой состав?
1) Три. 2) Четыре. 3) Пять. 4) Шесть. 5) Девять.
15. В описании строения пептидной группы
–С(О)–NH– определите неверный пункт.
1) Атомы углерода и азота, кислорода и водорода,
образующие пептидную группу, лежат в одной
плоскости и находятся в sр3-гибридном
состоянии.
2) Орбиталь, образованная неподеленной парой
электронов атома N, входит в сопряжение с
 -связью группы C=O.
Поэтому С–N-cвязь в пептидной группе короче
таковой в аминах.
-связью группы C=O.
Поэтому С–N-cвязь в пептидной группе короче
таковой в аминах.
3) Осевое вращение вокруг С–N-cвязи затруднено.
4) В сопряженной системе электронная плотность
смещена к атому кислорода.
5) Свободное вращение возможно вокруг связей 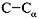 и и 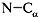 , но оно частично ограничено и
зависит от размеров, полярности и других свойств
радикала. , но оно частично ограничено и
зависит от размеров, полярности и других свойств
радикала.
16. Определите допущенную ошибку в описании
следующей записи:
-тир-вал-лиз-лей-глу-цис-.
1) На схеме показана первичная структура
фрагмента белковой молекулы, под которой следует
понимать определенную последовательность
аминокислотных остатков в полипептидной цепи.
2) Первичная структура белка генетически
предопределена.
3) Замена цистеина, например, на глутаминовую
кислоту или перестановка может сильно сказаться
на свойствах и биологических функциях белка.
4) Для поддержания первичной структуры белка
необходимо наличие как ковалентной, так и
водородной связи, которая возникает между
атомами О и Н в пептидной группе:
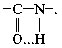
5) При гидролизе полипептидов разрывается
пептидная связь.
17. Определите ошибку в описании вторичной
структуры белковой молекулы.
1) У большей части белков полипептидная цепь
скручивается в 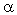 -спираль.
Это правозакрученная спираль с длиной витка 3,6
аминокислотных остатка. -спираль.
Это правозакрученная спираль с длиной витка 3,6
аминокислотных остатка.
2) Радикалы аминокислотных остатков направлены
внутрь спирали, поэтому получается плотная
упаковка молекулы белка.
3) Вторичная структура молекулы поддерживается
водородными связями между группами 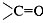 и и 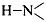 , расположенными на соседних витках
спирали. , расположенными на соседних витках
спирали.
4) В образовании водородных связей участвуют  -орбитали атома
кислорода. Таким образом на спирализованной
части молекулы создается единая сопряженная -орбитали атома
кислорода. Таким образом на спирализованной
части молекулы создается единая сопряженная  -система. -система.
5) Вторичная структура белка может быть
представлена другой структурой:
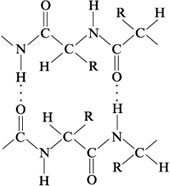
Водородные связи возникают межмолекулярно,
между разными полипептидными цепями. Это
 -структура.
-структура.
18. В каком описании третичной структуры белка
допущена ошибка?
1) Третичная структура белка – это
пространственная конфигурация молекулы белка,
которая возникает в результате нерегулярного
складывания и скручивания  - и - и  -конформаций. -конформаций.
2) Третичная структура возникает автоматически
в результате самопроизвольного закономерного
скручивания белковой молекулы. В процессе
образования нативной формы белка участвуют
также другие вещества. Нативная форма белковой
молекулы определяется последовательностью
чередования аминокислотных остатков в
полипептидной цепи и условиями, при которых
происходит образование нативной формы.
3) Третичная структура определяет
биологические функции белков.
4) Третичная структура белка поддерживается
различными видами химической связи, среди
которых можно выделить: ионную, ковалентную
дисульфидную, водородную, силы взаимодействия
полярных фрагментов молекулы со средой
(«гидрофобная связь»).
5) Третичная структура – пространственная
структура белка, устойчивая к воздействию
различных внешних факторов: температуре,
изменению рН среды, комплексообразователям
(ионам тяжелых металлов).
19. На схеме, приведенной далее, представлены
силы, поддерживающие третичную структуру
белковой молекулы. Укажите ионную связь.
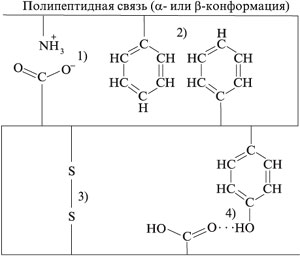
20. На схеме в задании 19 определите силы,
которые наиболее прочно фиксируют расположение
участков полипептидной цепи относительно друг
друга.
21. На схеме в задании 19 определите самую слабую
связь.
22. Какая связь будет нарушена при добавлении к
белку раствора восстановителя, например
сульфида аммония? (См. задание 19.)
23. Из задания 19 выберите связь, которая будет
нарушена при добавлении к раствору белка
кислоты.
24. Укажите соединение, являющееся наиболее
сильным денатурирующим фактором, если вещества
взяты в умеренных концентрациях.
1) Nа3PO4.
2) K4P2O7.
3) NaCl.
4) LiHСО3.
5) 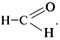
6) Ca3(PO4)2.
25. Декапептид с указанным набором
аминокислотных остатков:
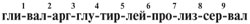
был подвергнут действию протеолитического
фермента аминопептидазы. Какие вещества
окажутся в растворе после окончания гидролиза?
1) Исходный декапептид будет расщеплен на
отдельные аминокислоты.
2) В гидролизате будут обнаружены следующие
пептиды:
гли-вал-арг, глу-тир-лей-про-лиз, сер-вал.
3) В растворе обнаружится аминокислота глицин и
оставшийся нонапептид.
4) Будет расщеплена связь тир-лей, в растворе
окажутся два пептида.
5) Гидролизу подвергнется концевая связь
сер-вал, в растворе окажется аминокислота валин и
нонапептид.
26. Укажите номера пептидных связей, которые
будут подвергнуты гидролизу с участием фермента
трипсина (см. задание 25).
1) 9. 2) 4. 3) 3 и 8. 4) 1 и 9. 5) 7.
27. Какая связь будет разрушена под действием
фермента карбоксипептидазы на декапептид,
представленный в задании 25?
1) 1. 2) 4. 3) 5. 4) 7. 5) 9.
28. Какая связь будет прежде всего разрушена
при гидролизе декапептида из задания 25 в
присутствии разбавленного раствора минеральной
кислоты?
1) 1. 2) 4. 3) 5. 4) 7. 5) 9.
6) Данный гидролиз не является избирательным.
Все связи будут разрушаться приблизительно в
равной степени.
29. С помощью какой реакции можно различить два
следующих пептида:
гли-вал-лей-цис-арг-глу-тир-тре-ала
и
ала-цис-лей-арг-вал-гис-глу-ала-асп?
1) Реакция Миллона.
2) Биуретовая реакция.
3) Реакция с нингидрином.
4) Ксантопротеиновая реакция.
5) Реакция с солью свинца(II).
30. Какое вещество из следующего перечня в
значительном количестве содержится в твороге?
1) Казеин.
2) Ферритин.
3) Гемоглобин.
4) Зрительный пурпур.
5) Капсулярные белки бактерий.
6) Вирусы.
31. В задании 30 укажите металлопротеид.
32. В задании 30 укажите хромопротеид, в молекуле
которого простетическая группа представлена 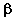 -каротином. -каротином.
33. Белки какого из представленных классов
растворимы в воде?
1) Альбумины.
2) Глобулины.
3) Проламины.
4) Гистоны.
34. Для белков какого класса (см. задание 33)
характерно увеличение растворимости при
подкислении раствора?
35. Белки какого класса (см. задание 33)
нерастворимы в воде, но растворимы в растворах
нейтральных солей, например NaCl?
| 
