Цель урока: изучение строения атома
алюминия, его химических свойств, выявление
взаимосвязи между физическими свойствами и
областями использования данного металла,
выяснение способа его получения на основе
имеющихся у учащихся знаний.
Задачи:
Актуализировать знания учащихся о строении
атома, физических смыслах порядкового номера,
номера группы, номера периода на примере
алюминия. Показать зависимость физических свойств
алюминия от наличия в нем металлической связи и
особенностей кристаллического строения. Сформировать у учащихся знания о том, что
алюминию в свободном в состоянии присущи особые,
характерные физические и химические свойства.
Развивающие:
Возбуждать интерес к изучению науки путем
предоставления кратких исторических и научных
сообщений о прошлом, настоящем и будущем
алюминия. Продолжить формирование исследовательских
навыков учащихся при работе с литературой,
выполнением лабораторной работы. Расширить понятие амфотерности раскрытием
электронного строения алюминия, химических
свойств его соединений.
Воспитательные:
Воспитывать бережное отношение к окружающей
среде, предоставляя сведения о возможном
использовании алюминия вчера, сегодня, завтра. Формировать умения работать коллективом у
каждого учащегося, считаться с мнением всей
группы и отстаивать свое корректно, выполняя
лабораторную работу. Знакомить учащихся с научной этикой, честностью
и порядочностью естествоиспытателей прошлого,
предоставляя сведения о борьбе за право быть
первооткрывателем алюминия.
Тип урока: изучение нового
материала.
Вид урока: лабораторный.
Оборудование: алюминий
металлический, сера, йод, растворы кислот и
щелочей, образцы природных соединений и сплавов
алюминия, штатив с пробирками, колбы, спиртовка,
бенгальские свечи, кусок алюминиевого провода,
наждачная бумага, фольга.
Средства обучения: Габриелян О.С. Химия 9
класс. Учебник , М.: Дрофа, 2011.; мультимедийная
презентация;
"Мультимедийное приложение. Виртуальная
лаборатория.”; рабочая карточка учащегося.
Ход урока
- Организационный момент: приветствие, проверка
явки учащихся, заполнение журнала.
- Проверка готовности учащихся к уроку: настрой
учащихся на работу, доведение до них плана урока.
Но прежде чем начать работу, мы
проверим домашнее задание.
Откройте тетради с домашним заданием.
На дом вам задавали параграф 12, упр 2 а и
б.
3. Император Наполеон III на банкете
велел подать для почтенных гостей приборы из
очень дорогого серебристо-белого металла. А всем
прочим было обидно до слёз: им пришлось
пользоваться золотой и серебряной посудой. Из
чего были изготовлены вилки? (Из алюминия). Слайд
№3.
Правильно, тема урока "Алюминий”
Мы сегодня познакомимся с алюминием, историей
открытия, его физическими, химическими
свойствами.
4.Физические свойства алюминия.
"Существует только один заменитель
воображения – опыт”. Д. Берджес
Лабораторная работа по теме:
"Физические свойства алюминия”.
Работу выполняют в парах. Работают по
инструктивным карточкам.
Изучение алюминия начинаем с
определения его физических свойств.
Цель исследовательской работы:
изучить физические свойства алюминия, выявить
закономерности между свойствами и областями
применения данного металла.
Инструктивная карта.
Задание
Изучите физические свойства по плану:
- Определите агрегатное состояние вещества при н.
у.
- Определите цвет вещества, обладает ли оно
металлическим блеском?
- Определите плотность по справочным таблицам и
сделайте вывод: является ли алюминий лёгким или
тяжёлым?
- Определите пластичность.
- Является ли проводником тока?
- Обладает ли ковкостью?
- Определить: тугоплавкий или легкоплавкий.
Выявите закономерности между свойствами и
областями применения данного металла.
Результат исследований поместите в таблицу.
| Физическое свойство |
Область применения |
| Лёгкий |
Самолётостроение |
| Пластичный |
Кухонная посуда |
| Хороший проводник электрического тока |
Электрические провода |
| Ковкий |
Фольга для пищевых продуктов |
Учащиеся рассматривают металлический
алюминий и характеризуют его физические
свойства: белый, лёгкий, пластичный, хороший
проводник электрического тока, 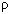 = 2,702 г/см3 , tплавл = 660 0С.
Следовательно, этот металл тугоплавкий или
легкоплавкий? = 2,702 г/см3 , tплавл = 660 0С.
Следовательно, этот металл тугоплавкий или
легкоплавкий?
Ответ – легкоплавкий. Ковкий, он легко
вытягивается в тончайшую проволоку и
прокатывается в тонкие листы. Демонстрирую
фольгу для пищевых продуктов.
Вывод.
Т.о. мы видим, что алюминий
используется во многих областях народного
хозяйства.
И изделия из алюминия производят в
Хабаровском крае на заводе строительных
алюминиевых конструкций.
5. Строение и свойства атома алюминия.
Учащиеся характеризуют положение
элемента в ПСХЭ, составляют электронную формулу,
дают общую характеристику элемента. (Протонов 13,
электронов 13, нейтронов 14, электронных слоёв 3,
число электронов на внешнем уровне 3). Следовательно, алюминий с лёгкостью
отдаёт 3 электрона, проявляя при этом постоянную
ст. ок. +3. Алюминий сильный восстановитель. Легко
окисляется.
6. Хим. свойства Al.
Какую информацию о свойствах металлов
можно получить на основании их положения в
электрохимическом ряду напряжений металлов?
Металлы в нём расположены в порядке
убывания восстановительных свойств при реакциях
в водных растворах в стандартных условиях.
Металлы, стоящие до Al, взаимодействуют с водой с
образованием щелочей. Они очень активны.
Al – единственный активный металл,
который используется в быту в чистом виде, т. к. он
покрыт тонкой оксидной плёнкой очень прочной.
Используется как абразивный материал.
План рассмотрения хим. свойств
алюминия:
- взаимодействие с неметаллами (кислородом,
бромом, йодом, серой, углеродом, азотом.)
Демонстрирует учитель.
(Демонстрация горения бенгальской
свечи)
А сейчас мы посмотрим опыт.
Виртуальная лаборатория.
С помощью самостоятельных
исследований вы должны ответить на вопрос:
является алюминий амфотерным металлом?
Обучающиеся делятся на группы и
проводят исследования.
Лабораторная работа: "Химические
свойства алюминия”.
Работу можно выполнять парами, можно
индивидуально. Это зависит от обеспеченности
кабинета оборудованием и реактивами. Проводится
инструктаж по правилам безопасного проведения
эксперимента:
- работа с кислотами и щелочами,
- нагревание веществ,
- чистота и порядок на рабочем месте,
- внимательность.
Инструктивная карта.
1. Возьмите две пробирки. В каждую
положите по кусочку алюминия. Прилейте в одну из
них
1-2 мл раствора соляной кислоты, а в
другую столько же раствора серной кислоты. Что
наблюдаете? Пробирки слегка нагрейте. Запишите
уравнения соответствующих реакций.
2. Кусочек алюминия поместите в
пробирку. Прилейте 1,5 мл концентрированной
серной кислоты. Что наблюдаете? Запишите
уравнение реакции.
3. В пробирку поместите кусочек
алюминия и прилейте раствор щёлочи. Содержимое
пробирки нагрейте. Что происходит? Запишите
уравнение реакции.
4. Результаты проделанной работы
оформите в таблицу:
№ опыта |
Исходные вещества |
Результат |
Уравнения реакций |
| |
|
|
|
| |
|
|
|
На доске записываются уравнения
реакций.
Вывод: алюминий амфотерный, т. к.
реагирует и с кислотами и со щелочами.
Закрепление.
Домашнее задание
- обязательное: прочитать §13, задание № 1 на
стр. 75;
- дополнительное: задание № 2 на стр. 75;
- творческое: создать презентацию на тему
"Алюминий”.
Сейчас прозвенит долгожданный звонок.
Увы, но к концу подошел наш урок.
Прошу, уберите рабочее место.
Давайте без слов, и пожалуй, без жестов.
А я благодарность вам всем объявляю,
Проверив работы, в журнал выставляю
Отметки все ваши, надеюсь привычно
Что будут они "хорошо” и "отлично”
Большое спасибо я вам говорю
Мы цели достигли. Благодарю!
| 
