Цели. Развить представления о
валентности как основном свойстве атома, выявить
закономерности изменения радиусов атомов
химических элементов в периодах и группах
периодической системы. Используя
интегрированный подход, развивать у учащихся
умения сравнивать, сопоставлять, находить
аналогии, предсказывать практический результат
на основании теоретических рассуждений. Cоздавая
ситуации успеха, преодолевать психологическую
инерцию учащихся. Развивать образное мышление,
способности к рефлексии.
Оборудование
. Таблица «Валентность и
электронные конфигурации элементов».
Эпиграф . «Логика, если она
отражается в истине и здравом смысле, всегда
ведет к цели, к правильному результату».
Урок комбинированный, с элементами интеграции.
Используемые методы обучения:
объяснительно-иллюстративный, эвристический и
проблемный.
ХОД УРОКА
I этап.
Ориентировочно-мотивационный
Урок начинается с «настройки» (звучит музыка –
симфония № 3 Й.Брамса).
Учитель
. Слово «валентность»(от лат.
«valentia») возникло в середине XIX в., в период
завершения химико-аналитического этапа развития
химии. К тому времени было открыто более 60
элементов.
Истоки понятия «валентность» содержатся в
работах разных ученых. Дж.Дальтон установил, что
вещества состоят из атомов, соединенных в
определенных пропорциях. Э.Франкланд,
собственно, и ввел понятие валентности как
соединительной силы. Ф.А.Кекуле отождествлял
валентность с химической связью. А.М.Бутлеров
обратил внимание на то, что валентность связана с
реакционной способностью атомов. Д.И.Менделеев
создал периодическую систему химических
элементов, в которой высшая валентность атомов
совпадала с номером группы элемента в системе. Он
же ввел понятие «переменная валентность».
Вопрос
. Что такое валентность?
Вчитайтесь в определения, взятые из разных
источников.
«Валентность
химического элемента –
способность его атомов соединяться с другими
атомами в определенных соотношениях».
«Валентность
– способность атомов одного
элемента присоединять определенное количество
атомов другого элемента».
«Валентность
– свойство атомов, вступая в
химические соединения, отдавать или принимать
определенное количество электронов
(электровалентность) или объединять электроны
для образования общих для двух атомов
электронных пар (ковалентность)».
Какое определение валентности, по вашему мнению,
более совершенно и в чем вы видите недостатки
других? (Обсуждение в группах.)
Валентность и валентные возможности – важные
характеристики химического элемента. Они
определяются структурой атомов и периодически
изменяются с увеличением зарядов ядер.
Что, по-вашему, означает понятие «валентная
возможность»?
Учащиеся высказывают свое мнение. Вспоминают
значение слов «возможность», «возможный»,
уточняют смысл этих слов в толковом словаре
С.И.Ожегова: «Возможность – средство, условие,
необходимое для осуществления чего-нибудь»;
«возможный – такой, который может произойти,
осуществимый, допустимый, дозволительный,
мыслимый».
Потом учитель подводит итог.
Учитель. Валентные возможности атомов
– это допустимые валентности элемента, весь
спектр их значений в различных соединениях.
II этап.
Операционно-исполнительный
Работа с таблицей «Валентность и электронные
конфигурации элементов».
Учитель
. Поскольку валентность атома
зависит от числа неспаренных электронов, полезно
рассмотреть структуры атомов в возбужденных
состояниях, учитывая валентные возможности.
Запишем электронографические формулы
распределения электронов по орбиталям в атоме
углерода. С их помощью определим, какую
валентность проявляет углерод С в соединениях.
Звездочкой (*) обозначают атом в возбужденном
состоянии:
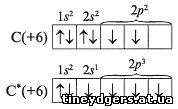
Таким образом, углерод проявляет валентность IV
за счет расспаривания 2s2-электронов и
перехода одного из них на вакантную орбиталь.
(Вакантный – незанятый, пустующий (С.И.Ожегов).)
Почему валентность С – II и IV,
а Н – I, Нe – 0, Be –
II, B – III, P – V?
Сопоставьте электронографические формулы
элементов (схема 1) и установите причину разной
валентности.
Работа в группах. 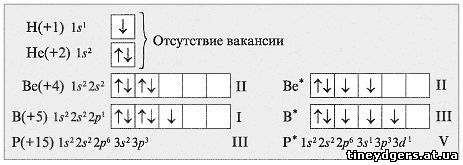
Учитель. Итак, от чего зависят
валентность и валентные возможности атомов?
Давайте рассмотрим эти два понятия во
взаимосвязи (схема 2). 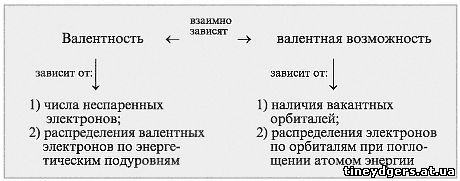
Расход энергии (Е) на перевод атома в
возбужденное состояние компенсируется энергией,
выделяющейся при образовании химической связи.
В чем отличие атома в основном (стационарном)
состоянии от атома в возбужденном состоянии
(схема 3)?
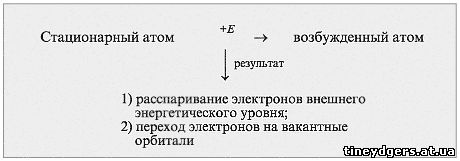
Учитель. Могут ли быть следующие
валентности у элементов: Li – III, O – IV,
Ne – II?
Поясните свой ответ, используя электронные и
электронографические формулы этих элементов
(схема 4).
Работа в группах. 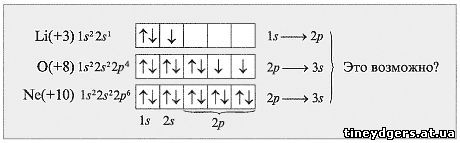
(Ответ. Нет, т. к. в этом случае
затраты энергии на перемещение электрона (1s 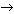 2p или 2p 2p или 2p 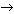 3s) настолько велики, что не
могут быть компенсированы энергией,
выделяющейся при образовании химической связи.) 3s) настолько велики, что не
могут быть компенсированы энергией,
выделяющейся при образовании химической связи.)
Учитель
. Есть еще один вид валентной
возможности атомов – это наличие неподеленных
электронных пар (образование ковалентной связи
по донорно-акцепторному механизму):
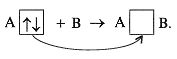
Например:
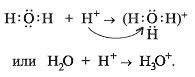
III этап.
Оценочно-рефлексивный
Подводятся итоги, характеризуется работа
учащихся на уроке (возвращение к эпиграфу урока).
Затем подводится резюме – отношение ребят к
уроку, учебному предмету, учителю.
Резюме
1. Что не понравилось на уроке?
2. Что понравилось?
3. Какие вопросы остались для тебя неясными?
4. Оценка работы преподавателя и своей работы
(обоснованная).
Домашнее задание
| 
