Тип урока. Комбинированный.
Методы обучения. Частично поисковый,
репродуктивный, программированный опрос, беседа
с элементами лекции.
Эпиграф к уроку. «Всякое вещество – от
самого простого до самого сложного – имеет три
различные, но взаимосвязанные стороны: свойства,
состав, строение…» (Б.М.Кедров).
Цели. Дидактическая: рассмотреть понятие
«валентность» как атомность элемента,
познакомить учащихся с различными видами
валентности (высшей и низшей, переменной и
постоянной).
Психологическая: вызвать интерес к предмету,
выработать умение логически рассуждать,
грамотно выражать свои мысли.
Воспитательная: развивать умение работать
коллективно, оценивать ответы своих товарищей.
Оборудование. Модели молекул воды,
углекислого газа, наборы для построения моделей
молекул различных веществ, индивидуальные
карточки для проверки домашнего задания и
самостоятельной работы учащихся в группе,
таблички-анаграммы для химической разминки,
шкала для определения эмоционального состояния
ученика.
ХОД УРОКА
Ориентировочно-мотивационный этап
Психологическая разминка
Цель разминки – определить эмоциональное
состояние учащихся. У каждого ученика на
внутренней стороне обложки тетради приклеена
табличка с шестью лицами – шкала для определения
эмоционального состояния (рис.). Каждый ученик
ставит галочку под той рожицей, чье выражение
отражает его настроение.
Учитель. Было бы
замечательно, если бы к концу урока каждому
удалось переместить галочку хотя бы на одну
клеточку влево.
Для этого нужно задуматься над вопросами: может
ли человек полюбить не очень интересный ему
учебный предмет? Что для этого нужно сделать?
Химическая разминка
Разминку готовят и проводят ученики.
Ученик. Анаграммы – это слова, в
которых изменен порядок букв. Попробуйте
разгадать некоторые из химических анаграмм.
Переставьте буквы в каждом слове и получите
название химического элемента. Обратите
внимание на подсказку.
«Одоврод» – у этого элемента самая маленькая
относительная атомная масса.
«Маилинюй» – этот элемент называют «крылатым»
металлом.
«Тьурт» – содержится в медицинском градуснике.
«Цалький» – без него наши кости были бы
непрочными и хрупкими.
«Росфоф» – веществом, состоящим из атомов
этого элемента, была намазана шерсть собаки
Баскервилей.
Учитель. Если вы легко разгадали
слова-анаграммы, скажите себе: «Я – молодец!»
Химические знаки и химические
формулы
(Проверка домашнего задания)
Индивидуальная работа у доски по
карточкам.
К а р т о ч к а 1
(примерные задания для карточек)
Задание 1. Разгадай загадку:
«И графит я, и алмаз,
В организме есть у вас,
Хоть в печах меня и жгут –
Черным золотом зовут!»
Задание 2. Ответь на вопросы.
1. Какой химический знак имеет этот элемент?
2. К металлам или неметаллам он относится?
3. Какова его относительная атомная масса?
4. Рассчитай массовую долю этого элемента в
соединении ЭО2.
|
Цифровой диктант
Контроль за выполнением диктанта учащиеся
осуществляют методом взаимопроверки.
Задание. Напротив правильных
утверждений поставьте цифру 1, напротив неверных
– 0.
1. Химический элемент – это определенный вид
атомов.
2. В каждой клетке таблицы Д.И.Менделеева, помимо
обозначения и названия элемента, записаны два
числа: верхнее – относительная атомная масса
элемента, нижнее – его порядковый номер.
3. Химический элемент галлий был назван так в
честь Франции.
4. В таблице Д.И.Менделеева элементы
располагаются, как правило, в порядке убывания их
атомных масс.
5. Значения относительной атомной массы и массы
атома, выраженной в а. е. м., никогда не совпадают
численно.
6. Простыми называют вещества, состоящие из
атомов одного элемента.
7. Индекс – это число, показывающее количество
взятых частиц (атомов или молекул) вещества.
8. Массовая доля элемента показывает, какую
часть (долю) составляет масса данного элемента от
всей массы вещества.
9. Относительная молекулярная масса воды Н2О
равна 20.
10. Массовая доля кальция в оксиде кальция СаО
составляет 71%.
П р а в и л ь н ы е о т в е т ы: 1 – 1, 2 – 0, 3 – 1, 4 –
0, 5 – 0, 6 – 1, 7 – 0, 8 – 1, 9 – 0, 10 – 1.
Операционно-исполнительный
этап
Учитель. Вы знаете, что химические
формулы веществ показывают количественные
соотношения, в которых атомы соединяются между
собой, вы также научились рассчитывать массовую
долю элемента по химической формуле вещества.
Например, в воде Н2О на один атом
кислорода приходится два атома водорода, или 11%
Н и 89% О. В углекислом газе СО2 на
один атом углерода приходится два атома
кислорода. (демонстрация моделей молекул
данных веществ.)
Валентность
Учитель. Валентность – это
способность атомов присоединять к себе
определенное число других атомов.
С одним атомом одновалентного элемента
соединяется один атом другого одновалентного
элемента (HF, NaCl). С атомом двухвалентного
элемента соединяются два атома одновалентного (H2O)
или один атом двухвалентного (CaO). Значит,
валентность элемента можно представить как
число, которое показывает, со сколькими атомами
одновалентного элемента может соединяться атом
данного элемента.
Правила определения валентности
элементов в соединениях
 Валентность водорода
принимают за I (единицу). Тогда в соответствии с
формулой воды Н2О к одному атому кислорода
присоединено два атома водорода. Валентность водорода
принимают за I (единицу). Тогда в соответствии с
формулой воды Н2О к одному атому кислорода
присоединено два атома водорода.
 Кислород в своих
соединениях всегда проявляет валентность II.
Поэтому углерод в соединении СО2
(углекислый газ) имеет валентность IV. Кислород в своих
соединениях всегда проявляет валентность II.
Поэтому углерод в соединении СО2
(углекислый газ) имеет валентность IV.
Учитель. Как определить валентность
элемента, исходя из таблицы Д.И.Менделеева?
У металлов, находящихся в группах а,
валентность равна номеру группы.
У неметаллов в основном проявляются две
валентности: высшая и низшая (схема).
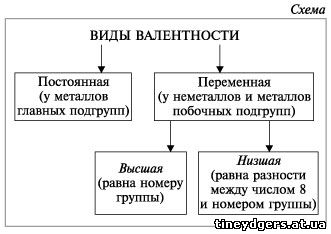
* Высшая валентность
равна номеру группы.
* Низшая валентность
равна разности между числом 8 (количество групп в
таблице) и номером группы, в которой находится
данный элемент.
Учитель. Например: сера имеет высшую
валентность VI и низшую (8 – 6), равную II; фосфор
проявляет валентности V и III.
Валентность может быть постоянной (у элементов
главных подгрупп таблицы Д.И.Менделеева) или
переменной (у элементов побочных подгрупп в
таблице), но с этим явлением вы познакомитесь
чуть позже, а если интересуетесь, то почитайте
учебник 9-го класса.
Валентность элементов необходимо знать, чтобы
составлять химические формулы соединений. Для
этого удобно воспользоваться следующей
таблицей.
Таблица
Алгоритм составления формулы
соединения Р и О
Последовательность
действий |
Составление формулы оксида
фосфора |
1. Написать символы элементов |
Р О |
2. Определить валентности
элементов |
V II
P O |
3. Найти наименьшее общее
кратное численных значений валентностей |
5•2 = 10 |
4. Найти соотношения между
атомами элементов путем деления найденного
наименьшего кратного на соответствующие
валентности элементов |
10 : 5 = 2, 10 : 2 = 5; P : О = 2 : 5 |
5. Записать индексы при
символах элементов |
Р2 О5 |
6. Формула соединения (оксида) |
Р2О5 |
Учитель. Запомните еще два
правила для составления химических формул
соединений неметаллов между собой.
1) Низшую валентность проявляет тот элемент,
который находится в таблице Д.И.Менделеева
правее и выше, а высшую валентность – элемент,
расположенный левее и ниже. (Демонстрация
таблицы Д.И.Менделеева.)
Например, в соединении с кислородом сера
проявляет высшую валентность VI, а кислород –
низшую II. Таким образом, формула оксида серы
будет SO3.
В соединении кремния с углеродом первый
проявляет высшую валентность IV, а второй –
низшую IV. Значит, формула – SiC. Это карбид
кремния, основа огнеупорных и абразивных
материалов.
2) В формулах соединений атом неметалла,
проявляющий низшую валентность, всегда стоит на
втором месте, а название такого соединения
оканчивается на «ид».
Например, СаО – оксид кальция, NaCl –
хлорид натрия, PbS – сульфид свинца.
Теперь вы сами можете написать формулы любых
соединений металлов с неметаллами.
Самостоятельная работа
Текст работы заранее написан на доске. Двое
учащихся решают задание на обратной стороне
доски, остальные в тетрадях.
Задание 1. Проверьте, правильно ли
написаны формулы следующих соединений: Na2S,
KBr, Al2O3,
Mg3N2, MgO.
Задание 2. Напишите формулы соединений
металлов с неметаллами: кальция с кислородом,
алюминия с хлором, натрия с фосфором. Назовите
эти соединения.
После выполнения работы ученики обмениваются
тетрадями, происходит взаимопроверка. Учитель
может выборочно проверить некоторые тетради,
похвалить тех учащихся, которые справились
быстрее всех и сделали меньше всего ошибок.
 Закрепление
изученного материала Закрепление
изученного материала
Беседа с учащимися по вопросам
1) Что такое валентность?
2) Почему валентность иногда называют
атомностью элемента?
3) Чему равны валентности водорода и кислорода?
4) Какие два значения валентности могут
проявлять неметаллы?
5) Как определить низшую и высшую валентности
неметаллов?
6) Как найти наименьшее общее кратное между
численными значениями валентностей?
7) Могут ли атомы в соединении иметь свободные
валентности?
8) Какой из двух неметаллов в химической формуле
их соединения занимает 1-е место, а какой –
2-е? Поясните на примере оксида NO2, используя
таблицу Д.И.Менделеева.
Творческая работа в группах
Задание. Используя наборы для составления
моделей молекул различных веществ, составьте
формулы и модели молекул для следующих
соединений:
1-я группа – меди и кислорода,
2-я группа – цинка и хлора,
3-я группа – калия и йода,
4-я группа – магния и серы.
После окончания работы один учащийся из группы
отчитывается о выполненном задании и вместе с
классом приводит анализ ошибок.
Задание на дом. По учебнику «Химия-8»
Л.С.Гузея: § 3.1, задания № 3, 4, 5, с. 51. Желающие могут
подготовить сообщения о французском ученом
Ж.Л.Прусте и английском ученом Дж.Дальтоне.
 Рефлексивно-оценочный этап и подведение итогов
урока
Рефлексивно-оценочный этап и подведение итогов
урока
Объявить оценки за урок отвечавшим ученикам,
поблагодарить всех за работу на уроке. Провести
оценку эмоционального состояния по шкале (см.
рис.). Учитель еще раз напоминает вопросы, над
которыми необходимо подумать для эффективной
работы на следующем уроке.
| 
