В химической науке есть особая область, которая изучает скорости и механизмы различных реакций, — химическая кинетика.
Хотя химическая теория может объяснить
многое, предсказать теоретически скорость любой реакции пока нельзя. Ее
изучают экспериментально, в лаборатории, и потом разрабатывают способы,
как эту скорость изменить. Есть немало реакций, важных для
промышленности, которые идут слишком медленно, нужно уметь их ускорять.
Другие реакции, напротив, приходится тормозить, потому что они вредны.
Словом, химическая кинетика —
экспериментальная наука. В справедливости ее законов можно убедиться,
поставив несколько несложных опытов.
Для начала удостоверимся в том, что
скорость одной и той же реакции действительно может изменяться, и
довольно значительно. (Впрочем, это можно предположить на основании не
химического, а жизненного опыта; к примеру, продукты на морозе портятся
медленнее, чем на жаре, потому что при разных температурах одни и те же
биохимические реакции идут с разными скоростями.)
Для проверки повторите опыт из главы
«Химические часы», но изменяйте на этот раз не концентрации веществ (это
вам уже знакомо), а температуру. Если оба исходных раствора — сульфата
натрия и йодата калия с серной кислотой — выливать в воду со льдом, то
времени до появления синей окраски пройдет заметно больше, чем при
использовании теплой воды. Заметьте только, что в очень горячей воде
окраска не появляется вовсе, так как окрашенное соединение иода с
крахмалом неустойчиво.
Итак, вы выяснили на опыте: чем выше
концентрация и температура, тем быстрее идет реакция. Но некоторые
реакции на первый взгляд кажутся исключением из правила. Вот пример.
Налейте в пробирку на высоту 1–2 см
уксусной кислоты и бросьте в нее несколько кусочков цинка. Цинк надо
предварительно очистить, погрузив его секунд на двадцать в раствор
соляной кислоты и промыв водой,
Уксусная кислота слабая, и цинк
растворяется в ней очень медленно — пузырьки водорода еле выделяются.
Как ускорить реакцию? Нагреть раствор. Правильно. А нельзя ли иначе?
Поступим так: понемногу станем добавлять в пробирку чистую воду, каждый
раз хорошо перемешивая. Внимательно последите за пузырьками.
Удивительное дело: кислота уже разбавлена вдвое, втрое, а реакция вместо
того чтобы замедляться, идет все быстрее!
Если вы ставите этот опыт на занятиях
кружка, то замените цинк маленьким кусочком магниевой стружки и ничем ее
не обрабатывайте. С разбавленной уксусной кислотой магний реагирует еще
энергичнее, чем цинк.
Такое «исключение» из правила
становится понятным, если его хорошо изучить. Наш опыт с уксусной
кислотой объясняется следующим образом. Скорость, с которой цинк или
магний взаимодействуют с кислотой, зависит от концентрации ионов
водорода в растворе. Эти ионы образуются при растворении в воде любой
кислоты. Но когда воды мало, слабая уксусная кислота находится в
растворе почти исключительно в виде недиссоциированных молекул. По мере
разбавления водой все больше молекул уксусной кислоты распадается на
ионы, и реакция идет быстрее. Но если добавить слишком много воды, то
реакция вновь замедлится, уже по другой причине: из-за сильного
разбавления концентрация ионов водорода опять уменьшится. Быстрее всего
реагирует с цинком 15 %-ная уксусная кислота.
Конечно, мы разобрали этот опыт отнюдь
не ради того, чтобы просто показать, какими необычными бывают химические
превращения. Мы хотели обратить ваше внимание вот на что: для
управления скоростью реакции обязательно надо знать, как она идет.
Всякая реакция начинается с того, что молекулы веществ сталкиваются друг с другом. Посмотрим, как начинается реакция.
Возьмите не очень широкую стеклянную
трубку длиной в несколько десятков сантиметров и подберите к ней две
пробки, С внутренней стороны, обращенной к трубке, вставьте в обе пробки
по небольшому стеклянному стерженьку и намотайте на них по кусочку
ваты. Один кусочек смочите несколькими каплями концентрированной соляной
кислоты, другой — концентрированным раствором аммиака. Одновременно
вставьте пробки с ватками в трубку с обеих концов. Через несколько минут
— в зависимости от длины трубки — в ней, ближе к ватке с соляной
кислотой, появится белое кольцо хлорида аммония NH4Cl. 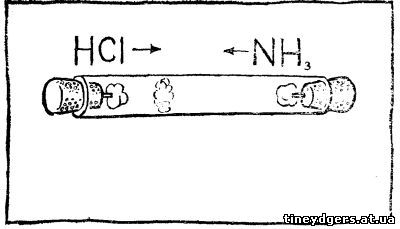
Обычно при химических реакциях смесь
перемешивают, чтобы процесс шел быстрее. Мы умышленно этого не сделали и
не пытались даже помочь молекулам встретиться — они двигались сами.
Такое самостоятельное передвижение молекул в той пли иной среде называют
диффузией. Испаряясь с ваты, молекулы обоих веществ испытывали
миллиарды столкновений в секунду с молекулами воздуха и друг с другом. И
хотя скорость молекул очень велика, она исчисляется сотнями метров в
секунду, при 0 °C и нормальном давлении свободный пробег, т. е.
расстояние, которое успевает пройти молекула от одного столкновения до
другого, составляет для этих веществ всего около 0,0001 мм. Поэтому-то
аммиак и хлористый водород (из соляной кислоты) так медленно двигались в
трубке. Столь же медленно распространяется по комнате с неподвижным
воздухом пахучее вещество.
Но отчего белое кольцо появилось не
посередине трубки? Оттого, что молекулы аммиака меньше, они продвигаются
через воздух быстрее. Если же из трубки откачать воздух, то молекулы
аммиака и хлористого водорода встретятся через доли секунды — длина
свободного пробега молекул значительно увеличится.
Советуем вам самостоятельно провести
небольшое исследование, чтобы узнать, как влияют на диффузию силы
тяжести и температура. Для этого располагайте трубку вертикально и
наклонно, а также нагревайте отдельные ее части (включая то место, где
оседает хлорид аммония). Выводы попробуйте сделать сами.
От газов перейдем к жидкостям. В них диффузия идет еще медленнее. Проверим это на опыте.
На гладкую и чистую стеклянную
пластинку капните рядом по нескольку капель трех жидкостей: в середине —
воды, по бокам от нее — растворов соды и соляной кислоты. Жидкости до
начала опыта не должны соприкасаться. Затем очень осторожно, избегая
перемешивания, палочкой соедините растворы. Должен выделяться диоксид
углерода, но это произойдет не сразу. А когда газ начнет выделяться, то
пузырьки его расположатся вдоль границы, разделяющей области диффузии
кислоты и соды.
Вместо соды и кислоты можно взять два
любых растворимых в воде вещества, которые при смешивании окрашиваются
или дают осадок. Впрочем, в таких опытах трудно избежать потоков
жидкости, искажающих картину, поэтому лучше ставить опыты в загущенных
растворах. А загущать их можно желатиной.
Приготовьте 4 %-ный раствор желатины,
опустив ее в горячую воду (не кипятить!). Горячий раствор налейте в
пробирку и, когда он остынет, в центр пробирки быстро, одним движением,
введите пинцетом кристаллик перманганата калия, медного купороса или
другого ярко окрашенного и растворимого в воде вещества. Пинцет сразу же
выньте осторожным, но быстрым движением. В течение нескольких часов
можно наблюдать очень красивую картину диффузии. Растворяемое вещество
распространяется во всех направлениях с одинаковой скоростью, образуя
окрашенную сферу.
С загущенным раствором можно поставить
еще один опыт. Налейте горячий желатиновый раствор в две пробирки и
добавьте в одну немного раствора щелочи, а в другую — фенолфталеина.
Когда содержимое пробирок застынет, пинцетом быстро введите в центр
первой пробирки кусочек таблетки фенолфталеина, в центр второй — комок
кальцинированной соды. В обоих случаях появится малиновая окраска. Но
заметьте: во второй пробирке окраска распространяется гораздо быстрее.
Ионы гидроксида, образовавшиеся при диссоциации щелочи, намного меньше и
легче сложной органической молекулы фенолфталеина, и поэтому они
движутся в растворе быстрее.
Перейдем теперь к твердым веществам. В
реакциях между ними (или между твердым веществом с жидкостью либо газом)
молекулы могут сталкиваться только на поверхности. Чем больше
поверхность раздела, тем быстрее идет реакция. Убедимся в этом. Железо
на воздухе не горит. Однако это справедливо только для железных
предметов. Например, у гвоздей поверхность соприкосновения с воздухом
невелика, реакция окисления идет слишком медленно. Железные опилки
реагируют с кислородом намного быстрее: на холоду раньше превращаются в
ржавчину, а в пламени могут и загореться. Мельчайшие же крупинки
способны вспыхнуть вообще без нагревания. Такое железо называют
пирофорным. Его невозможно настругать даже самым мелким напильником, так
что получают его химическим путем, например, разлагая соль щавелевой
кислоты — оксалат железа.
Смешайте водные растворы какой-либо
соли двухвалентного железа, например железного купороса, и щавелевой
кислоты или ее растворимой соли. Желтый осадок оксалата железа
отфильтруйте и заполните им пробирку не более чем на пятую часть объема.
Нагрейте вещество в пламени горелки, при этом держите пробирку
горизонтально или чуть наклонно, отверстием вниз и в сторону от себя.
Выделяющиеся капли воды снимайте жгутом фильтровальной бумаги или ватой.
Когда оксалат разложится и превратится в черный порошок, закройте
пробирку и охладите ее.
Понемногу и очень осторожно высыпайте
содержимое пробирки на металлический или асбестовый лист: порошок будет
вспыхивать яркими искрами. Особенно эффектен опыт в затемненном
помещении.
Важное предупреждение: пирофорное
железо нельзя хранить, это может привести к пожару! По окончании опыта
порошок обязательно прокалите на воздухе или обработайте кислотой, чтобы
не осталось несгоревших частиц — они могут самовоспламениться.
Далее исследуем, как влияет размер
поверхности твердого вещества на скорость его реакции с жидкостью.
Возьмите два одинаковых кусочка мела и один из них разотрите в порошок.
Поместите оба образца в пробирки и залейте одинаковыми объемами соляной
кислоты. Мелкораздробленный мел, как и следовало ожидать, растворится
гораздо быстрее. Еще один кусочек мела поместите в пробирку с серной
кислотой. Начавшаяся было энергичная реакция вскоре затихает, а затем и
вовсе прекращается. Отчего же? Ведь серная кислота не слабее соляной…
При реакции мела с соляной кислотой образуется хлорид кальция СаСl2
который легко растворяется в воде и не мешает притоку к поверхности
мела новых порций кислоты. При взаимодействии с серной кислотой
получается сульфат кальция CaSO4, а он очень плохо
растворяется в воде, остается на поверхности мела и закрывает ее. Чтобы
реакция пошла дальше, надо время от времени очищать поверхность мела или
заранее превратить его в порошок. Знание таких подробностей процесса
очень важно для химической технологии.
И еще один опыт. Смешайте в ступке два
твердых вещества, дающих окрашенные продукты реакции: нитрат свинца и
иодид калия, железный купорос и красную кровяную соль, и т. д. — и
разотрите смесь пестиком. Постепенно, по мере растирания, смесь начнет
окрашиваться, так как поверхность взаимодействия веществ все
увеличивается. Если же налить на смесь немного воды, то сразу появится
интенсивная окраска — ведь в растворе молекулы передвигаются значительно
легче.
И в заключение опытов по кинетике
поставим количественный эксперимент; единственный инструмент, который
понадобится, — это секундомер или часы с секундной стрелкой.
Приготовьте 0,5 л 3 %-ного раствора
серной кислоты (лить кислоту в воду!) и столько же 12 %-ного раствора
тиосульфата натрия. Перед растворением тиосульфата добавьте в воду
несколько капель нашатырного спирта.
На две цилиндрические склянки (стаканы,
стопки) вместимостью 100 мл нанесите метки на уровне 50; 25; 12,5 и
37,5 мл, последовательно разделяя высоту пополам. Пометьте склянки и
налейте в них до верхних меток (50 мл) приготовленные растворы.
Обычный тонкий стакан вместимостью 200
или 250 мл поставьте на темную бумагу и вылейте в него раствор
тиосульфата, а затем — кислоты. Сразу заметьте время и перемешивайте
смесь в течение одной-двух секунд. Чтобы не разбить стакан, лучше
пользоваться деревянной палочкой. Как только раствор начнет мутнеть,
запишите время, прошедшее с начала реакции. Опыт удобно проводить
вдвоем: один следит за часами, другой сливает растворы и сигнализирует о
помутнении.
Вымойте стакан и проведите опыт еще
трижды; раствор тиосульфата наливайте в стакан до третьей (37,5), второй
(25) и первой (12,5 мл) меток, доливая каждый раз воду до верхнего
деления. Количество кислоты во всех опытах остается постоянным, и общий
объем реагирующей смеси всегда равен 100 мл.
Теперь начертите график: как зависит
скорость реакции от концентрации тиосульфата. Концентрацию удобно
выразить в произвольных единицах: 1, 2, 3 и 4. Отложите их на оси
абсцисс. Но как подсчитать скорость реакции?
Точно это сделать нельзя хотя бы
потому, что момент помутнения мы определяем на глаз, в известной мере
субъективно. К тому же помутнение показывает только, что мельчайшие
частицы серы, которые выделяются в ходе реакции, достигли такого
размера, что их можно заметить. И все же, за неимением лучшего, примем
начало помутнения за окончание реакции (что, кстати, не очень далеко от
истины). Сделаем еще одно допущение: скорость реакции обратно
пропорциональна ее продолжительности. Если реакция шла 10 секунд, то
будем считать, что скорость равна 0,1. Отложите скорости на оси ординат.
Четыре опыта дали четыре точки, пятая —
начало координат. Все пять точек расположатся примерно на одной прямой.
Ее уравнение записывается так:
v == k [Na2S2O3]
где v— это скорость реакции, квадратные скобки — принятое в химической кинетике обозначение концентрации, а k— константа скорости, которую легко найти из графика.
Но скорость реакции должна зависеть и
от концентрации серной кислоты. Оставляя количество тиосульфата
неизменным и разбавляя серную кислоту, проверьте, как изменяется
скорость реакции. Как ни странно, она не меняется!
Такие случаи не редкость. В нашем опыте
идет сложная реакция, и ее продукт — сера выделяется не сразу при
непосредственных столкновениях молекул тиосульфата и кислоты. И вообще
реакций, где продукты получаются сразу, не так уж много.
В сложных последовательных
реакцияхкакая-то стадия протекает медленнее остальных. В нашем случае —
последняя, в которой и образуется сера. Именно ее скорость мы, по сути
дела, и измеряли.
| 
