Цель игры: контроль за уровнем
усвоения учащимися знаний и умений по теме
"Металлы и их соединения”
Игровая задача: правильно выполняя
задания каждого этапа игры, команда должна
заработать как можно больше подсказок, с помощью
которых можно узнать металл и составить о нём
рассказ.
Учебная задача: каждый участник игры
должен решить расчётную задачу,
экспериментальную задачу на распознавание
солей, выполнить тест и составить уравнения
реакций, соответствующие цепочке превращений.
Эта работа учащегося оценивается индивидуально.
Подготовка к игре. Четырёх учащихся
из класса учитель назначает консультантами. Они
сдают зачёт досрочно, решают все задания своего
этапа. Класс делится на 4 команды по 5 человек.
Каждый ученик получает зачетный лист, где
указаны его фамилия и имя, названия этапов игры,
где консультанты будут проставлять баллы за
выполнение заданий. В кабинете столы ставятся
так, чтобы удобно было работать четырём группам
учащихся, например по 2 стола в четырёх углах
класса, по 6 стульев у каждой пары столов. На
столах должны быть таблички с названиями этапов.
Учитель готовит дидактический материал (тесты,
задачи, цепочки превращений) и оборудование для
распознавания (пронумерованные пузырьки
с растворами солей, реактивы и
пробирки для проведения опытов)
, карточки с подсказками.
Непосредственно перед игрой
консультанты получают пакеты с заданиями,
критериями оценки, комплекты подсказок для
каждой команды в конвертах разных цветов.
Например, красный цвет будет соответствовать
подсказкам про серебро, синий – про золото,
зелёный – про свинец, жёлтый – про ртуть.
Ход игры: Учитель сообщает о том, что
каждая команда должна пройти 4 этапа и набрать
как можно больше баллов и
подсказок для того, чтобы узнать металл и
составить о нём рассказ, который прозвучит в
конце урока. На каждом этапе команда может
задержаться не больше 8 минут. После этого каждая
команда получает маршрутный лист определённого
цвета, на котором указана последовательность
прохождения этапов. Такого же цвета команде
будут выдаваться подсказки на каждом этапе.
Этап "Тестирование”.
Консультант выдаёт игрокам чистые
листы бумаги, ручки и тесты. На чистых листах
каждый ученик подписывает свою фамилию.
Консультант объясняет задание: выписать номера
правильных утверждений, и засекает 5 минут (с
помощью песочных или наручных часов). Через 5
минут он собирает и проверяет работы. В тесте
пять правильных ответов, они идут под номерами 1,
4, 5, 8, 10. Если ученик выбрал все утверждения верно,
ему в зачётный лист ставится "5”, и выдаётся
подсказка. Если одно утверждение неверное, или
выбраны 5 верных утверждений и одно лишнее –
ставится "4”, подсказка не выдаётся, если
выбрано 2 ошибочных или лишних утверждения –
"3”, подсказка не выдаётся, если более 2
ошибочных или лишних утверждения – "2”.
Подсказки красного цвета:
самородный, драгоценный, бактерицидный,
электропроводный, звонкий.
Подсказки синего цвета: мягкий,
пластичный, драгоценный, самородный, химически
пассивный.
Подсказки зелёного цвета: мягкий,
тяжёлый, сине-серый, легкоплавкий, ядовитый.
Подсказки жёлтого цвета: тяжёлый,
ядовитый, легкоплавкий, низкая
электропроводность, низкая теплопроводность.
Тест 1.
1. При взаимодействии натрия с водой
образуется щёлочь.
2. Соли алюминия окрашивают пламя в зелёный цвет.
3. Красная кровяная соль – качественный реактив
на ионы железа 3+.
4. Гидроксид кальция называют гашёной известью.
5. Натрий можно получить электролизом расплава
хлорида натрия.
6. При сгорании лития на воздухе образуется
пероксид лития.
7. Оксидная плёнка защищает железо от дальнейшей
коррозии.
8. Оксид алюминия при спекании с кристаллическими
щелочами образует соли алюминаты.
9. Алюминий – редкий элемент.
10. Железо входит в состав гемоглобина.
Тест 2.
1. При взаимодействии натрия с
кислородом образуется пероксид натрия.
2. От лития к цезию плотность щелочных металлов
уменьшается.
3. Одна из важнейших руд, используемых для
получения железа – пирит.
4. Щелочные металлы были открыты раньше, чем
алюминий.
5. Жёлтая кровяная соль – качественный реактив на
соли железа 3+.
6. Поташ – одно из соединений алюминия,
используемое в качестве удобрения.
7. При взаимодействии железа с соляной кислотой
образуется хлорид железа (III).
8. Кальций был открыт Дэви.
9. Ионы железа входят в состав хлорофилла.
10. Алюминий используется как восстановитель в
металлургии.
Тест 3.
1. При обычных условиях алюминий не
реагирует с водой.
2. Основной компонент соды – карбонат кальция.
3. Щелочные металлы получают в промышленности
электролизом растворов их солей.
4. Гидроксид железа (II) самопроизвольно
окисляется во влажном воздухе в гидроксид железа
(III)
5. В состав гипса входит сульфат кальция.
6. Железо в природе часто встречается в
самородном виде.
7. Гидроксид магния проявляет амфотерные
свойства.
8. С увеличением атомной массы температура
плавления щелочных металлов понижается.
9. Жёлтая кровяная соль является качественным
реактивом на соли железа 2+.
10. Магний входит в состав хлорофилла.
Тест 4.
1. При растворении кальция в воде
образуется известковая вода.
2. С увеличением атомной массы химическая
активность щелочных металлов уменьшается.
3. При взаимодействии железа с газообразным
хлором получается хлорид железа (II).
4. Корунд состоит из оксида алюминия.
5. Соли натрия окрашивают пламя в жёлтый цвет.
6. Для получения натрия из руды в промышленности
используют алюминотермию.
7. Алюминаты образуются при взаимодействии
алюминия с кислотами.
8. Первое железо, попавшее в руки человека, было
метеоритного происхождения.
9. Одним из самых распространённых в природе
соединений магния является известняк.
10. Ионы кальция участвуют в процессе свёртывания
крови.
Тест 5.
1. Магний сгорает на воздухе со
вспышкой, что раньше использовалось при
фотографировании.
2. От лития к цезию температура плавления
щелочных металлов возрастает.
3. Железо используют в пирометаллургии как
восстановитель.
4. Гидроксид алюминия проявляет амфотерный
характер.
5. Красная кровяная соль – качественный реактив
на соли железа 2+.
6. Соли калия окрашивают пламя в жёлтый цвет.
7. Щелочные металлы были открыты Д.И. Менделеевым.
8. В состав мрамора входит карбонат кальция.
9. Железо растворяется в воде при обычных
условиях с выделением водорода.
10. Ионы калия и натрия участвуют в проведении
нервного импульса.
Этап "Расчётные задачи”
Консультант выдаёт игрокам чистые
листы, ручки, калькуляторы, таблицы Д.И.
Менделеева, листы с задачами. На каждом листе
задачи на "3”, "4” и "5”. Учащийся сам выбирает
уровень сложности задачи, решает её на
подписанном чистом листе. Через 7 минут работы
консультант собирает решения и выкладывает
перед игроками цветные карточки подсказками
вниз, на верхних сторонах карточек написаны
числа, соответствующие ответам задач. Каждый
игрок называет полученный им ответ и берёт
соответствующую подсказку. В целях экономии
времени консультант проверяет решения и ставит
отметки позже.
Подсказки красного цвета: монеты,
медаль, зеркало, фотография, прожектор.
Подсказки синего цвета: монеты,
медаль, купола, зубные протезы, корона..
Подсказки зелёного цвета: пули,
припой, аккумулятор, белила, сурик.
Подсказки жёлтого цвета: термометр,
краски, серебряная вода, старинные зеркала, лампы
дневного света.
Вариант 1.
Задача на "3”. Сколько граммов железа
можно получить алюминотермическим способом из 32
граммов оксида железа (III)?
Задача на "4”. Сколько граммов железа
можно получить алюминотермическим способом из 40
граммов красного железняка, содержащего 80%
оксида железа (III)?
Задача на "5”. Сколько граммов железа
можно получить с помощью угарного газа из 50,2
граммов красного железняка, содержащего 75%
оксида железа (III), если
практический выход железа составляет 85% от
теоретического?
Ответ во всех задачах: 22,4 грамма.
Вариант 2.
Задача на "3”. Сколько литров водорода
выделится при взаимодействии алюминия с
раствором, содержащим 7,3 г хлороводорода?
Задача на "4”. Сколько литров водорода
выделится при взаимодействии алюминия с 73
граммами 10% раствора хлороводорода?
Задача на "5”. Сколько литров водорода
выделится при взаимодействии 6 граммов алюминия
с 36,5 г 20% раствора хлороводорода?
Ответ во всех задачах : 8,96 литров.
Вариант 3.
Задача на "3”. Сколько граммов меди
можно получить вытеснением её из раствора,
содержащего 8 граммов сульфата меди (II)
цинком?
Задача на "4”. Сколько граммов меди
можно восстановить цинком из 200 г 4% раствора
сульфата меди (II)?
Задача на "5”. Сколько граммов меди
получится при взаимодействии 5,6 граммов железа с
50 граммами 16% раствора сульфата меди (II)?
Ответ во всех задачах: 3,2 грамма.
Вариант 4.
Задача на "3”. Сколько граммов
хлороводорода должно содержаться в соляной
кислоте, чтобы реакция со 140 граммами железа
прошла полностью?
Задача на "4”. Сколько граммов 10%
раствора хлороводорода потребуется для реакции
с 14 граммами железа?
Задача на "5”. Сколько граммов 10%
раствора хлороводорода потребуется для реакции
с 15,2 граммами чугуна, содержащего 8%
неметаллических примесей?
Ответ во всех задачах: 182,5 грамма
Вариант 5.
Задача на "3”. Сколько литров водорода
выделится при растворении в воде 9,2 граммов
натрия?
Задача на "4”. Сколько литров водорода
выделится при взаимодействии с водой амальгамы
натрия массой 29,3 грамма, если массовая доля
натрия в ней 31,4%?
Задача на "5”. Сколько литров водорода
выделится при взаимодействии с водой сплава
натрия с калием массой 12, 4 грамма, если массовая
доля натрия в нём 37,1%?
Ответ во всех задачах: 4,48 литра.
Этап "Цепочки превращений”
Консультант выдаёт игрокам чистые
листы, ручки, таблицы растворимости и задания.
Через 7 минут консультант собирает работы.
Выкладывает перед игроками подсказки, на верхних
сторонах которых написаны формулы веществ Х. За
правильное определение вещества Х,
игроки получают подсказку, за
составление уравнений в молекулярном и ионном
виде, разбор одного из уравнений с точки зрения
окисления-восстановления – отметку (за каждое
уравнение – 1 балл). В целях экономии времени
консультант проверяет и оценивает выполнение
задания позже.
Подсказки красного цвета: Луна,
ляпис, белый, украшения, столовые приборы.
Подсказки синего цвета: Солнце,
жёлтый, Клондайк, украшения, философский камень.
Подсказки зелёного цвета: Сатурн,
хрусталь, радиация, старинные печати,
антидетонатор.
Подсказки жёлтого цвета: Меркурий,
амальгама, киноварь, сулема, каломель.
Вариант 1.
Запишите уравнения реакций,
соответствующие цепочке:
железо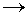 Х Х 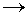 гидроксид железа (III) гидроксид железа (III) 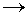 нитрат железа(III).
нитрат железа(III).
Вещество Х – это:
а) сульфид железа (II); б) хлорид железа
(II); в) хлорид железа (III); г) оксид железа(III).
Последнюю реакцию запишите в ионном
виде, для первой составьте электронный баланс.
(Ответ: Х – в)
Вариант 2.
Запишите уравнения реакций,
соответствующие цепочке:
натрий 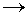 Х Х 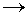 оксид натрия оксид натрия 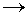 хлорид
натрия. хлорид
натрия.
Вещество Х – это:
а) карбонат натрия; б) гидроксид натрия;
в) пероксид натрия; г) сульфат натрия.
Последнюю реакцию запишите в ионном
виде, для первой составьте электронный баланс.
(Ответ: Х – в)
Вариант 3.
Запишите уравнения реакций,
соответствующие цепочке:
карбонат кальция 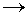 Х Х 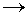 хлорид кальция хлорид кальция  кальций
кальций
Вещество Х – это:
а) гидроксид кальция; б) оксид кальция;
в) кальций; г) нитрат кальция
Вторую реакцию запишите в ионном виде,
для последней составьте электронный баланс.
(Ответ: Х – б)
Вариант 4.
Запишите уравнения реакций,
соответствующие цепочке:
алюминий 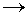 Х Х 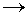 оксид алюминия оксид алюминия 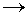 нитрат
алюминия. нитрат
алюминия.
Вещество Х – это:
а) хлорид алюминия; б) алюминат натрия;
в) фторид алюминия; г) гидроксид алюминия
Последнюю реакцию запишите в ионном
виде, для первой составьте электронный баланс.
(Ответ: Х – г)
Вариант 5.
Запишите уравнения реакций,
соответствующие цепочке:
гидроксид магния 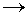 Х Х 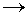 сульфат магния сульфат магния 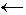 магний
магний
Вещество Х – это:
а) оксид магния; б) магний); в) силикат
магния; г) нитрат магния
Вторую реакцию запишите в ионном виде,
для последней составьте электронный баланс.
(Ответ: Х – а)
Этап "Распознавание солей”.
Консультант выдаёт команде чистую
бумагу, ручку, таблицу растворимости, набор
реактивов, чистые пробирки или ячейки для
капельного анализа, четыре
пронумерованных пузырька с растворами солей и
задание: используя минимум реактивов,
определите, в каком пузырьке находится каждая из
солей: хлорид натрия, хлорид бария, хлорид магния,
хлорид железа (II). Команда
составляет план распознавания, записывает
уравнения используемых реакций в молекулярном и
ионном виде, выполняет задание практически и
сообщает консультанту ответ. Если все вещества
определены правильно, уравнения составлены в
молекулярном и ионном виде – каждый из команды
получает в зачётный лист "5”, если определены
правильно все вещества, но в уравнениях есть
ошибки, или определены 2 вещества, и все уравнения
составлены правильно – каждый участник получает
"4”, если правильно определено 1 вещество,
правильно составлены все уравнения реакций,
или правильно определены 2 вещества,
но есть ошибки в уравнениях реакций – каждый
получает "3”, если ни одно вещество не
определено, или определено одно и уравнения
составлены с ошибками – члены команды получают
"2”. Подсказка выдаётся только в случае
правильного распознавания всех веществ.
Подсказка красного цвета: считают,
что военачальники армии Александра
Македонского, вторгшейся в Индию, заражались
желудочно-кишечными заболеваниями гораздо реже,
чем солдаты, потому что пили из бокалов,
сделанных из этого металла.
Подсказки синего цвета:
Нильс Бор, спасаясь от гитлеровских
оккупантов, покидая Копенгаген, не рискнул взять
с собой нобелевскую медаль, растворил её в
"царской водке”, а вернувшись, выделил из
раствора этот металл и сделал такую же медаль.
Подсказки зелёного цвета:
считают, что водопровод в Древнем
Риме, сделанный из этого металла, стал одной из
причин упадка Римской империи
Подсказки жёлтого цвета:
один из самых длительных опытов в
истории химии, который шёл 12 дней, провёл
Лавуазье. Он нагревал этот металл в запаянной
реторте, металл частично превратился в оксид.
Этим опытом Лавуазье доказал, что масса веществ в
ходе реакции не изменяется.
По прохождении всех этапов, команда
сдаёт зачётные листы консультантам для
выставления оценок, анализирует собранные
подсказки, угадывает металл и составляет рассказ
о свойствах и применении данного металла.
Консультанты считают сумму баллов, набранных
каждой командой. Победившей считается команда,
которая правильно угадала металл и набрала
наибольшее количество баллов.
Примерные тексты рассказов о металлах.
Серебро – самородный металл,
практически белого цвета, поэтому алхимики его
изображали знаком Луны. Серебро имеет самую
высокую электропроводность из всех металлов и
применяется в электротехнике. Особенность
серебра – звонкость, поэтому из него делали
бубенцы и колокольчики. Серебро – драгоценный
металл, из него изготовляют монеты, медали,
ювелирные украшения, столовые приборы.
Соединения серебра применяют в фотографии.
Высокая отражательная способность серебра
используется в зеркалах и прожекторах. Серебро
обладает бактерицидным действием, а нитрат
серебра (ляпис) используется в медицине как
прижигающее и обеззараживающее средство.
Золото – самородный металл жёлтого
цвета. Алхимики обозначали его знаком Солнца.
Золото – самый пластичный и очень мягкий металл,
поэтому из него делают тончайшую фольгу, которой
золотят купола храмов. Это драгоценный металл,
поэтому из него делают деньги, медали, ювелирные
украшения. Золото обладает высокой химической
стойкостью, не реагирует с кислотами,
растворяется только в "царской водке”, поэтому
его сплавы используют для
изготовления зубных протезов. В истории
человечества известны периоды "золотой
лихорадки”, когда на вновь найденное
месторождение золота устремлялась масса людей в
надежде обогатиться. Одним из таких
месторождений был Клондайк.
Свинец – мягкий серо-синий металл, с
древности известный людям. Алхимики обозначали
его знаком Сатурна. Свинец достаточно
легкоплавкий металл, входит в состав припоя, в
старину из него делали печати. Соединения свинца
используют как краски (свинцовые белила,
свинцовый сурик). При добавлении в стекло оксида
свинца получают хрусталь. Свинец и оксид свинца
используется в аккумуляторах. Свинцовые
пластины задерживают радиацию. Свинец входит в
состав антидетонаторов (например,
тетраэтилсвинец добавляют в бензин). Свинец –
тяжелый металл, поэтому из него изготовляют пули.
Его ионы вызывают денатурацию белка, поэтому
соединения этого металла ядовиты.
Ртуть – самый легкоплавкий металл,
единственный из металлов, находящийся при
нормальных условиях в жидком состоянии, он
обладает самой низкой тепло- и
электропроводностью. Алхимики обозначали ртуть
знаком Меркурия. Латинское название ртути
переводится как "серебряная вода”. Широкое
применение находят амальгамы – растворы
металлов в ртути. Раньше с помощью амальгам
изготовляли зеркала. Сейчас ртуть используется в
измерительных приборах (например, термометрах), в
лампах дневного света, как материал электродов.
Соединения ртути применяются как краски
(киноварь, сулема), в электродах (каломель).
Большинство соединений ртути и пары ртути
ядовиты.
| 
