На современных подводных судах, в кабинах
стратостатов воздух непрерывно очищается от избытка выделенного дыханием
экипажа угольного ангидрида раствором едкого калия, который можно
заменить и едким натром.
Таким образом, наш предыдущий опыт
иллюстрирует одно из применений химии к технике и дает нам практическое
указание, как очистить спертый воздух в комнате больного, если врач
запретил открывать в ней форточку.
Тарелки с налитым в них раствором щелочи быстро поглотят вредный избыток угольного газа и облегчат дыхание больного.
Кстати, вот что говорит об угольном ангидриде, выдыхаемом нашими легкими, один английский врач. Обыкновенной мерой испорченности данного образца
воздуха считается количество содержащейся в нем углекислоты, хотя надо
заметить, что этот газ, полученный в химически чистом виде, может быть
вдыхаем в больших количествах, не причиняя вредных последствий. Эти
вредные последствия не наступают, пока количество углекислоты не
превосходит 5 частей на 100. Если же, наоборот, углекислота получается
путем дыхания, то результат оказывается иным, так как в данном случае в
углекислоте содержатся органические примеси весьма вредного свойства.
Так, эффект, получаемый при вдыхании воздуха, содержащего 1 1/2 части
выдохнутой углекислоты на 1000, совершенно таков же, как при вдыхании
воздуха, вдесятеро более богатого угольным ангидридом, но только
полученного химическим путем.
Химические мотыльки
Чтобы воспроизвести этот опыт, возьмите
бутыль с широким горлом, заткнутым пробкой, с пропущенной через нее
воронкой с широким носиком. Если такой стеклянной воронки не найдете в
продаже, склейте ее из тонкого картона. В бутылке получаете углекислый
газ действием соляной кислоты на двууглекислую соду. Бросьте в воронку
легонький шарик, плотно закрывающий ее отверстие. Я брал для этого
маленький пустотелый шарик из целлулоида (огнеопасен), но лучше, если
сможете сделать его из сердцевины бузины или подсолнуха. Вырезав грубо
что-то близкое по форме к шарику, его окатывают между ладонями, пока
форма не приблизится к вполне шарообразной.
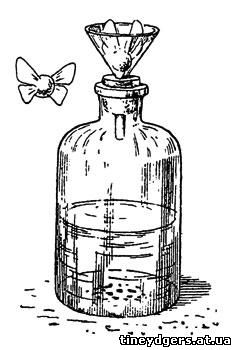
Рис. 35. Химические мотыльки
Для красоты к шарику приклейте вырезанные
из тонкой папиросной бумаги крылышки бабочки, приподняв их кверху.
Советую, предварительно смочив бумагу синей лакмусовой настойкой,
вырезать из нее крылышки после того, как она просохнет.
Как только угольного ангидрида соберется
достаточно, чтобы преодолеть вес шарика, он вырывается из бутылки
(особенно при взбалтывании последней), подбрасывая "химическую бабочку"
вверх. Взлетев на небольшую высоту, она снова опускается вниз, опять
закрывая воронку. Взлет и опускание продолжаются, пока не выделится весь
углекислый газ. Крылышки голубого мотылька при этом розовеют.
По совести говоря, без приклеенных крылышек
шарики работают лучше, и их можно бросить в воронку тогда сразу
несколько (два-три). Крылышки же не только меняют свой цвет на розовый,
но и намокают, мешая плотному соприкосновению шарика со стеклом воронки,
но зато опыт с бабочками красивее.
Итак, проделывая опыт, в случае неудачи
оборвите у ваших "бабочек" крылья и довольствуйтесь "химической пляской"
бузинных шариков.
Подводная лодка из коробочки
Интересную вариацию опыта с ныряющим и
выплывающим яйцом дает в пересказе из французского журнала "Nature"
русский специалист по любительским опытам, скрывший свое имя под
псевдонимом Тит Т.[27] Вот как он описывает этот опыт:
"При продаже аптекарских материалов нередко
встречаются высокие, круглые (цилиндрические) коробочки. В донышке
такой коробочки проколите несколько отверстий, а в крышке одно побольше,
центральное. Через это последнее должен проходить стержень (булавка,
проволока) двойного клапана, составленного из картонного кружка (снизу) и
широкой пробки (сверху); пригодна пробка от баночки с горчицей.
(Рисунок 36, направо, изображает коробочку и клапан в ее крышке).
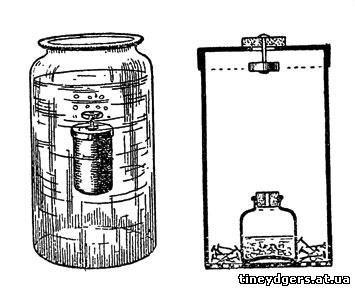
Рис. 36. Подобие химического «вечного» двигателя
"Внутри коробочки скройте "газовый
двигатель", который будет приводить в движение вашу коробку, если вы
опустите ее в воду. На том же рисунке вы видите, что этот двигатель
представляет собою маленький пузырек, наполовину насыпанный смесью
равных количеств соды и виннокаменной кислоты. Пузырек закрывается
пробочкой со сквозным отверстием достаточной ширины.
"Для лучшей устойчивости коробочки, на дно ее прибавьте какой-нибудь груз, например, мелких гвоздей.
"В большую стеклянную банку с водой
опустите дном вниз готовую и закрытую коробочку; вода будет входить в
нее через нижние отверстия, а воздух выходит сверху через клапан, и
коробочка опустится в воду. Но вот начинает работать газовый двигатель: в
пузырек попадает немного воды, смачивает порошок, и из него сейчас же
выделяется в большом количестве углекислый газ, который наполняет
коробочку и вытесняет из нее воду через отверстия в дне: при этом все
время, пока коробочка находится под водой, отверстие в крышке остается
прикрытым картонным кружком клапана, потому что легкая пробка,
поднимаемая давлением воды, тянет клапан кверху. Коробочка, наполненная
газом, снова всплывает вверх; первою показывается из воды пробка, клапан
опускается под действием веса пробки, газ выходит наружу, и вода снова
наполняет коробку. Прибор опять опускается на дно, пока новое количество
воды не попадает в скрытый внутри пузырек".
На рис. 36, налево, изображен весь аппарат в
уменьшенном виде с коробкой, поднимающейся кверху. "Подводная лодка"
идет ко дну, когда все количество взятой соды и кислоты нейтрализуют
друг друга, и больше она уже не всплывает.
Вредные газы, приносящие пользу
Некий профессор орнитологии разделял всех птиц на "полезных", "полезно-вредных", "вредно-полезных" и "просто вредных".
Такую более чем "оригинальную"
классификацию никак нельзя применить к газам, так как все они без
исключения, смотря по применению, могут быть и полезны и вредны. Мы
видели, как ядовит хлор, но знаем, с какой пользой его можно применять.
Газы, о которых у нас пойдет речь, и с
которыми мы проделаем ряд интересных опытов, конечно, все могут
приносить - и подчас приносят - вред, но люди научились извлекать из них
и пользу.
Это будут газы, образуемые серой в ее
соединениях с кислородом (сернистый газ) и водородом (сероводород), и
уже отчасти знакомый нам аммиак.
Дар вулканов
"Прелесть! Так бы и стоял и смотрел без
устали хоть целую неделю, не отрывая глаз. Этот кратер кажется лугом из
тощей травы и шелковистого мха, густо покрытых блестящей пылью, с
просвечивающей бледной зеленью, которая то постепенно переходит в самые
темные цвета апельсиновых листьев и даже в коричневый цвет, то вновь
светлеет, переходя в оранжевый и светло-золотистый; и, наконец, все эти
переливы завершаются нежно-красным цветом только что распустившейся
розы. В одном месте виднеется яма, в другом выступы наподобие ледяных
сосулек; в некоторых из них стенки покрыты узорчатой сетью из серых
кристаллов. Самые стены провала блестят желтой оторочкой из серы".
Так пишет наш старый любимец, шутник Марк Твэн, но на этот раз пишет совершенно серьезно. Это -
описание красоты кратера Везувия, одной из природных "химических
лабораторий", изготовляющих серу.
Вероятно, на Луне, с ее некогда развитой вулканической деятельностью, этот элемент находится в изобилии.
Спрос на серу со стороны техники очень велик.
Вы, быть может, и не подозреваете всей важности этого элемента для народного хозяйства.
Ну, на что сера может идти? Она входит в
состав пороха, ее порошком обсыпают "заболевшие" виноградники, при ее
посредстве мягкий каучук вулканизируют в твердый эбонит, прекрасный
изолятор электричества.
Но это далеко не все. Вы забыли самое главное: из серы делают серную кислоту.
Не думайте, что последняя нужна только для
наполнения стаканчиков, помещаемых на зиму между оконными рамами. Легче
перечислить химические производства, обходящиеся без этой страшной
жидкости, чем составить полный список ее применений!
Серная кислота нужна для получения азотной,
соляной, уксусной и других кислот, соды, стекла, целлулозы, йода,
суперфосфатных удобрений, сернокислого аммония, квасцов, фосфора,
медного, железного и других купоросов, нитей для электрических ламп,
алюминия, эфира, керосина, бензина, минеральных масел, парафина,
глицерина, стеарина, динамита, целлулоида, патоки, бумаги, искусственных
красок, лекарств и сотен других веществ, без которых немыслима
современная наука, техника, жизнь.
Умышленно я не внес в этот список спичек,
чтобы вы не подумали, что речь идет о зловонных "серничках", теперь
совершенно вышедших из употребления, а во времена моей юности бывших
чуть ли не самым распространенным источником быстрого получения огня.
Нет, не они, а современные "шведские"
спички требуют серной кислоты для получения веществ, входящих в состав
их головок и зажигательной массы бумажек, наклеенных на коробках.
Для получения же серной кислоты нужен
сернистый газ - продукт горения серы, а следовательно, и сама она.
Потому-то этот дар вулканов и важен для человечества, потому-то и
старается оно пополнить его недостаток, выжигая серу из колчедана
(сернистого железа).
Опыты с сернистым газом
Опыты эти надо производить очень осторожно и внимательно.
Запах горящей серы отвратителен и удушлив.
На свежем воздухе мы, не рискуя здоровьем, можем ознакомиться с ним,
если кому-либо он еще неизвестен. Сожжем для этого немного серы, положив
ее хотя бы на кирпич. Удобнее взять серу в порошке (серный цвет).
Зажегши кучку такого порошка, прикроем ее
цветочным горшком, поместив в нем несколько разных цветов, стебельки
которых укрепляем в отверстии горшечного дна (рис. 37). Цветы
предварительно увлажняем водой.

Рис. 37. Обесцвечивание цветов
Даже на расстоянии вы ощущаете запах
сернистого газа, и у вас першит в горле. Подумайте, каково приходится
рабочим, занятым выплавкой серы! А в Сицилии этим занимаются подростки,
чуть ли не дети, и топливом, за отсутствием лесов на острове, служит
сама же сера. Эта работа - сущий ад!..
Но вот наша сера сгорела. Поднимаю горшок и
вынимаю из него цветы. Желтые и белые, как можете видеть, не изменили
своей окраски, остальные сильно побледнели, а некоторые и совсем
обесцветились. Фиалки, например, стали снежно-белыми. Таких в природе и
не бывает!
Оставьте цветы лежать на воздухе. Постепенно их первоначальная окраска вернется.
Сернистым газом, значит, можно белить, но
он много дороже хлора и в технике применяется только для беления дорогих
шелковых и шерстяных изделий, соломы для шляп и кожи для обуви. Он не
разрушает, подобно хлору, отбеливаемые вещества.
Сжигаю еще кусочек серы в стеклянном цилиндре, положив его в железную ложечку и налив на дно цилиндра немного воды.
Взбалтываю ее и примешиваю синей лакмусовой настойки. Жидкость краснеет.
Сернистый газ, растворяясь в воде,
соединяется с частью ее в непрочную и слабую сернистую кислоту.
Сернистую, а не серную. Последнюю приготовить труднее. Сера, как и
многие другие элементы, дает с кислородом два соединения: газообразный
сернистый ангидрид и твердый - серный. Оба соединяются с водою, давая
соответственные кислоты.
Раньше для получения столь нужной в технике
серной кислоты сернистый газ окисляли в серный ангидрид в обширных
свинцовых камерах, вводя его туда вместе с водным паром и окислами
азота. Газ отнимал от последних кислород и с водой давал серную кислоту,
а окислы азота, отдававшие свой кислород, сами собой окислялись снова,
беря кислород из воздуха. Сернистый газ "не умеет" этого делать. Кислота
получалась слабая, ее надо было сгущать выпариванием - операция дорогая
и опасная. Теперь сернистый газ направляют на губчатую платину,
обладающую способностью сгущать в себе кислород и отдавать его
сернистому газу, а потом опять поглощать его из воздуха. Воды берется
как раз столько, чтобы получить кислоту нужной концентрации.
Гашение огня горящей серой
Химия - парадоксальная наука! Она учит нас,
что пожары не всегда следует гасить водой, так как вода подчас только
усиливает бушующую огненную стихию. Мало того: химия научила пожарных
гасить огонь... серой.
- Как, серой? Ведь она сама так хорошо горит!
Вот именно! Потому-то она и применима для гашения пожаров, что развивает при горении тяжелый, не поддерживающий горения газ.
Когда, как говорят, "выкинет из трубы",
когда загорится сажа, наполнившая давно нечищенные дымоходы, то,
конечно, можно влезть на крышу и лить воду в печную трубу.
Огонь при этом погаснет, но грязная вода через печное отверстие зальет квартиру, а это удовольствие не из самых приятных.
Другое дело, если в этом случае вместо
гашения водой начать жечь в печи серу. Тяжелый сернистый газ наполнит
дымоходы и прекратит доступ в них воздуха, так что огонь сам собою
погаснет.
Средство далеко не всем известное, но, безусловно, верное.
Зеленый лев
- Не бывает зеленых львов, львы желтые! -
скажете вы. Совершенно верно. Мой лев тоже, как видите, желтый, но он
сейчас позеленеет... от страха перед удушливым газом.
Я вырезал моего льва из куска картона и выкрасил раствором хромово-кислого калия, подкисленным соляной кислотой.

Рис. 38. Лев, позеленевший от действия сернистого газа
Зажигаю на тарелке кучку серного цвета,
увлажняю слегка своего "льва" водою, взбрызнув его для "бодрости" из
пульверизатора, сажаю на тарелку и прикрываю колпаком (рис. 38); можно
взять, как я указал раньше, большую закупоренную бутылку с отрезанным
дном. Лев "не выносит" удушливого запаха горящей серы и вскоре
становится совершенно зеленым.
Что же происходит при этом? А вот что: сернистый ангидрид восстанавливает желтую хромовую соль в зеленую окись хрома.
Белый снегирь
О белом вороне каждый из вас слышал, хотя,
кажется, никто такого ворона не видел, а вот о белом снегире, полагаю,
вам и слышать не приходилось. Хотите, покажу его?
Вот чучело этой перелетной птички с ее
ярко-розовой грудью (наряд самцов; снегириха одевается скромнее: вся в
сером). Несколько лет она была моим другом и утешала меня своими
"песнями", имитирующими скрип несмазанной двери, пока не погибла жертвой
общительности своего характера и желания вести дружбу с одним веселым
котенком. После того как это "знакомство" состоялось, мне осталось
только... набить из моего маленького друга чучело. Оно сейчас послужит
нам для доказательства, что снегири могут и цветом оправдать свое
название (только не живые, конечно).
Ставлю его под колпак, где был лев, и повторяю опыт.
Совершенно белым он не стал, но его яркая грудь, как видите, побелела.
В практике этим способом обесцвечивают птичьи перья перед окраской их в самые неестественные цвета для украшения дамских шляп.
А обесцвеченные перья промывают в спирте.
Газ тухлых яиц
Если вам случалось разбить тухлое яйцо, то
вы знаете запах сероводорода, так как от его-то присутствия в гниющих
белковых веществах и зависит зловоние испортившегося яйца.
Газ этот не только омерзительно пахнет, но
он крайне ядовит. Он иногда скопляется в сточных трубах и тому подобных
местах гниения органических отбросов.
Химикам, работающим в лабораториях часами в
атмосфере со следами этого газа, приходится отделываться только
головной болью, иногда рвотой. Но лаборанты всегда предупреждают впервые
приступающих к работе с газом, что, как только они перестанут ощущать
его зловоние, значит дело плохо - надо немедленно бежать на свежий
воздух.
Говорят - "клин клином вышибай".
Действительно, противоядиями против большинства газов служат вещества,
сами по себе ядовитые. Не всегда два яда усиливают действие друг друга
(хотя бывает и это), - иногда они взаимно нейтрализуют свое вредное
действие. Так, противоядием при отравлении сероводородом служит наш
старый знакомый - ядовитый хлор.
Нюхайте хлорную известь, если вдохнули сероводород.
Заметим, что в химических лабораториях
нельзя обойтись без этого газа. Чистый сероводород и сернистый аммоний -
важнейшие указатели состава веществ.
Я беру на кончик ножа щепотку черного
порошка сернистого железа, всыпаю его в пробирку и, прилив несколько
капель соляной кислоты, поскорее передаю пробирку вам. Понюхайте, не
поднося слишком близко к носу!
Не правда ли, пахнет вовсе не розами?
Ядовитый сам по себе, сероводород, сгорая,
развивает тоже не безвредный сернистый газ. Горит он, - а в смеси с
воздухом взрывает, - почти так же хорошо, как водород. Рабочие перед
спуском в колодцы и т. п. места иногда предварительно опускают туда
зажженную свечу, чтобы испытать, можно ли там свободно дышать.
Катастрофический случай массового
отравления сероводородом произошел в 1896 г. в Англии при постройке
маяка на дне одного из морских заливов. Газ со дна моря проник в кессон,
в котором работало 35 человек. Свечи, освещавшие кессон, стали светить
зеленым пламенем, у рабочих закружилась голова, их стало тошнить. Они
бросились из кессона и все спаслись, но долго страдали от последствий
отравления. На три дня работы приостановили, а затем администрация
послала в кессон 14 наиболее крепких рабочих. Перед самым концом смены
струя газа вновь хлынула в кессон, семерым удалось спастись, восемь были
извлечены в бессознательном состоянии. Один из них ослеп, другой сошел с
ума, остальные тоже стали инвалидами.
В прежнее время, когда газовое освещение
еще не было вытеснено электричеством, очистка светильного газа от
неизбежной, но весьма нежелательной примеси к нему сероводорода
производилась сложным химическим путем и весьма удорожала себестоимость
газа.
И все-таки этот зловредный газ ученые сумели сделать для нас необходимым, применяя его, как я сказал, в химических лабораториях.
Дело в том, что все металлы соединяются с
серой, давая характерные для каждого из них вещества. Анализируя
какое-либо тело, то-есть исследуя его состав, химик действует на его
раствор сернистым аммонием и сероводородом и по характеру получаемых
сернистых соединений, их растворимости или нерастворимости в воде и
кислотах, по цвету осадка и прочим данным выводит заключение, какие
именно металлы и в каких количествах входят в состав данного минерала,
сплава и т. п.
Не думайте, что это имеет только научный,
отвлеченный интерес. Нет, практическое значение этих реакций велико и в
технике и в общественной санитарии. При их помощи, например, определяют
присутствие ядовитых солей металлов в различных пищевых веществах и т.
п. Советские химики недавно указали на возможность применения
сероводорода при протравливании семян и для борьбы с бичом наших
зернохранилищ - амбарным клещом.
Наконец, следует сказать, что сероводород в
соединении с другими веществами входит в состав некоторых особо
целебных минеральных вод (Мацеста и др.).
Кое-что о трехцветных кошках
Как из белой кошки можно получить
трехцветную, да еще с рисунком полос и пятен, расположенных по вашему
желанию, да так, как они никогда не располагаются у живых кошек?
Такое превращение осуществимо только с кошками, вырезанными, как и наш "зеленый лев", из картона.
Вот беленькая картонная "киска". Ставлю ее
на тарелку, на которой насыпан какой-то грязновато-белый порошок, и
прикрываю стеклянным колпаком (рис. 39). Смотрите. Наша кошка
превратилась в трехцветную, ее белая шерстка покрылась черными и желтыми
полосами.

Рис. 39. «Превращение» белой кошки в трехцветную
Понюхайте порошок. Он пахнет сероводородом.
Это - сернистый кальций, соединение, непрочное на воздухе,
присоединяющее воду и выделяющее кислород, постепенно переходя в
известь.
В былые времена, когда соду получали из
поваренной соли действием на нее серной кислоты и дальнейшим
превращением сернокислого натрия (глауберовой соли) в сернистый, а затем
обжигом с известняком в углекислый, - в качестве побочного продукта
получался сернистый кальций.
Для содовых заводов он являлся тяжелым
бременем. Спрос на него в технике был невелик, и целые горы этого
зловонного вещества, скопившись на заводе, отравляли окрестный воздух. В
Англии сернистый кальций содовых заводов вывозили на специальных баржах
в открытое море и там топили.
Впоследствии научились регенерировать из
сернистого кальция серу, а затем были найдены лучшие способы получения
самой соды, при которых никаких остатков не получается. Нынешняя химия
вообще не знает "отбросов".
Возвращаюсь к кошке. Полосы на ней были
нанесены заранее. Те, что почернели, были сделаны раствором
уксуснокислого свинца, пожелтевшие - раствором хлористой сурьмы. Оба
раствора бесцветны; полосы, нанесенные кисточкой, после того как они
просохли, были совершенно незаметны, пока кошка оставалась белой.
Превращение белой кошки в черную
А вот другая кошка, тоже вырезанная из картона и тоже белая.
Сажаю ее в компанию с трехцветной.
Посмотрим, какое произойдет превращение.
Оказывается, она стала вся совершенно
черной, без отметины, только телесно-розовый носик и ярко-желтые глаза
выделяются на общем черном фоне.
На этот раз я покрыл носик кошки раствором
хлористого марганца, глаза - хлористым кадмием, а все остальное - тем же
уксуснокислым свинцом (яд!).
Уксуснокислый свинец сладок; растворяясь в
жесткой воде, он дает осадок белого углекислого свинца. Фальсификаторы
вин в капиталистических странах учитывают оба эти обстоятельства и
"сдабривают" для придания вину мягкости и вкуса дешевые сорта вин
свинцовым сахаром. О том, как это отражается на желудках потребителей,
они не задумываются, их больше интересует прибыль...
В этих и многих других случаях подмесь
свинцовых соединений к пищевым продуктам и открывает сероводород: он
срывает с них невинную белую или цветную маску (применяются цветные
соединения свинца) и обнаруживает их подлинную черную натуру.
Свинцовые краски - одна из главных профессиональных опасностей для рабочих, изготовляющих их, а также маляров.
У нас применение и изготовление свинцовых красок, как вредных, с 1930 г. совершенно воспрещено.
Отчего темнеют картины
Прежние художники, и не только
доморощенные, писали при помощи свинцовых белил и других свинцовых
красок, темнеющих с течением времени от сероводорода, - а он в ничтожных
количествах имеется в воздухе жилых помещений. Перекись водорода
окисляет образовавшийся черный сернистый свинец в белый - сернокислый.
От следов сероводорода в воздухе комнат
чернеет и серебро, покрываясь тонким слоем сернистого серебра, легко
удаляемого механической чисткой серебряных изделий мелом.
Заметим еще, что белая фильтровальная
бумага, смоченная раствором уксуснокислого или азотнокислого свинца (все
соли этих кислот растворимы), служит хорошим показателем присутствия в
воздухе сероводорода. Там, где он есть, бумажка чернеет даже тогда,
когда самое чуткое обоняние не в силах ощутить его запах.
Немного истории
Алхимики утверждали, что их наука возникла в
мифической Атлантиде, некогда поглощенной океаном со всеми своими
обитателями. Атлантам, якобы, была известна тайна превращения всех
металлов в золото. Иные шли еще дальше, уверяя, что еще "прародитель"
всего человечества Адам и другие библейские персонажи - Авраам, Моисей и
прочие, были причастны к деланию золота.
Все эти сказки придумывались в средние
века, а старейшие письменные источники, указывающие на знакомство с
химическими процессами, относятся к третьему веку нашей эры. Это
египетские папирусы (рукописи на пергаменте), хранящиеся в Нидерландском
музее в Лейдене. Их собрал в Египте в начале прошлого века один швед.
Часть их извлечена из гробниц Фив. В них приводятся рецепты закалки
металлов, изготовления стекла, искусственных драгоценных камней и...
размножения золота.
Древние египтяне были неплохими химиками.
Они знали много различных химических соединений и умело пользовались ими
как лекарствами, красильными пигментами, дубильными веществами,
плавнями в металлургии и... как ядами.
Клятва неофитов, приступавших к изучению
оккультных наук (к каковым относилась долгое время и химия) листом
персикового дерева весьма знаменательна. Персиковый лист был символом
молчания. Добавлю - вечного, так как в косточках персика находится (хотя
и в едва уловимых количествах) один из сильнейших ядов - синильная
кислота.
Не ею ли заставляли египетские жрецы навсегда умолкнуть неосторожного, выдавшего какую-нибудь тайну непосвященным?
Самое слово химия происходит, как думают,
от древнего названия Египта: страна Кэми или Хэми. Там возникла эта
паука еще в те времена, когда вся Европа была покрыта первобытным лесом,
служившим убежищем для диких зверей и не менее диких людских орд,
задолго до возникновения культур Эллады и Рима.
Возможно, впрочем, и другое происхождение
названия науки о веществе-химии. Оно могло произойти и от греческих
слов: либо от слова 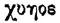 - сок, либо от - сок, либо от  - лить; но во всяком случае химия и древний Египет тесно связаны друг с другом. - лить; но во всяком случае химия и древний Египет тесно связаны друг с другом.
Богу Аммону-Ра был посвящен знаменитый храм
в оазисе Синах, лежавшем в Ливийской пустыне. Многочисленные караваны
паломников посещали ярам, и помет верблюдов служил им топливом в
холодные ночи. Из сажи, остававшейся от этого топлива, готовили жрецы
храма особую летучую соль Аммона.
Отсюда и произошло название аммиака и его соединений.
Рис. 40. Добывание аммиака
Действительно, аммиачные соединения
выделяются и могут быть получаемы при сухой перегонке органических
веществ и их остатков" Позже эти соединения стали добывать в больших
количествах при перегонке угля. Сейчас одно из аммиачных удобрений,
играющее большую роль в интенсивном сельском хозяйстве, сернокислый
аммоний, получают из отходящих газов заводских печей, - интересный
пример утилизации отбросов производства!
С хлористой солью аммония, нашатырем, мы имели уже случай ознакомиться при первом же опыте, описанном в этой книге.
Мы получили ее взаимодействием аммиачного
газа и паров соляной кислоты (хлороводорода). Из нее-то нагреванием с
гашеной известью (гидратом окиси кальция) и получают аммиак в школьных
опытах. Прибор для этого ничем, кроме расположения сосудов, не
отличается от аппарата для получения хлора. Так как аммиак несколько
легче воздуха, то сборный сосуд при этом помещают отверстием вниз.
Можно, впрочем, собирать его и под водой, только последняя должна быть
при этом сильно нагрета, так как в холодной воде газ прекрасно
растворим. Неудобство же последнего способа ясно: растворяясь в воде,
аммиак будет выделяться не только в сборный сосуд, но и прямо в
окружающий воздух из воды, наполняющей пневматическую ванну.
Много проще брать для опытов готовый
аммиак. Его водный раствор, как я уже говорил, называется нашатырным
спиртом. Опять же пренеудачное название: со спиртами, как понимают это
слово химики, он ничего общего не имеет. В 1898 г. знаменитый английский
химик Крукс грозил человечеству близким наступлением "азотного голода",
в результате истощения залежей Чилийской селитры. Перспектива грозная.
Азотистые соединения необходимы истощенным полям как искусственное
удобрение; без азотистых соединений приходится отказаться от
огнестрельного оружия, так как в состав всех видов пороха входит азот.
Мыслимо ли для капиталистических государств такое насильственное
разоружение!
И мысль буржуазных химиков заработала в
направлении - как использовать безграничный, запас свободного азота в
окружающем нас воздушном океане, как соединить его, например, с
водородом, превратив в аммиак, из которого уже легко получить другие
соединения азота?
Что азот непосредственно соединяется с
водородом в аммиак, это-то давно знали, но только... при обыкновенной
температуре такая реакция протекает годами, а при повышенной дает
ничтожный процент выхода аммиака.
Выручили катализаторы. Усовершенствовало
процесс повышенное давление. В присутствии соединений урана и при
давлении в 200 атмосфер удалось через 10 лет после исторической речи
Крукса получить первые 10 куб. см жидкого аммиака.
Сейчас производство аммиака синтетическим путем идет у нас в заводском масштабе.
Химическое хлебопечение
В сущности говоря, всякое хлебопечение
сопровождается целым рядом химических процессов. Подъем кислого теста -
результат жизнедеятельности дрожжевых грибков, превращающих сахаристые
вещества теста (декстрозы) в спирт и угольный ангидрид. Последние,
выделяясь из теста, делают хлеб рыхлым, пористым, удобно перевариваемым
нашим организмом. Так как состав и качество продажных дрожжей далеко не
всегда одинаковы, то при этом трудно бывает точно угадать время, нужное
для подъема теста. Иногда оно и совсем не всходит, "садится", как
говорят, давая плотный, трудно переваримый хлеб. Гораздо проще, удобнее и
чище заменить живых газообразователей "порошком для печения". Это
двууглекислый аммоний, разлагающийся во время печения хлеба на летучий
аммиак и угольный ангидрид.
Такой способ применяется в бисквитном производстве.
Домашний огнегаситель
Упустишь огонь - трудно потушить. Поэтому
на случай пожара следует всегда иметь под рукой средство для прекращения
его в самом начале.
Ведро воды?
Да, во многих случаях это средство
отличное, но не во всех. Вспыхнувший спирт, керосин, бензин, и т. п.
водой не загасишь: они вспыхивают над нею, продолжая гореть. Страшные
пожары на нефтяных промыслах гасят не водой, а песком.
Тоже хорошее средство, но тоже не всегда
удобное. Не держать же в комнате бочку с песком! Да и тяжел он, -
обращаться с ним неудобно. Однако, при химических работах, требующих
нагревания на спиртовой лампочке, рекомендуется иметь под руками ящик с
песком, чтоб гасить им разлившийся и загоревшийся спирт. То же можно
посоветовать всем, имеющим дело с примусами и т. л. приборами.
На чем основано гашение пожаров? Как я уже
говорил, рассказывая о гашении горящей серой загоревшейся в дымоходах
сажи, - на прекращении доступа воздуха к огню. В огнегасителях это
достигается быстрым выделением этими приборами угольного ангидрида.
Без отказа работает склянка с нашатырным
спиртом. Его всегда надо иметь в домашней аптеке и для нейтрализации
кислот, и для вывода жирных пятен, и в качестве самого дешевого и верно
действующего огнетушителя.
От высокой температуры пламени аммиак
выделяется из раствора и отделяет горящее тело от окружающего воздуха;
сам же он горения не поддерживает.
Глядите: в сосуд с аммиаком я опускаю зажженный огарок свечи, - он гаснет.
Однако не странно ли: ведь сам-то аммиак горит! Добавлю: не в воздухе, а в чистом кислороде.
Опасность безопасных веществ
Желтоватый раствор, которым на одну шестую
наполнена эта пробирка, - раствор иода в растворе йодистого калия.
Доливаю пробирку до половины нашатырным спиртом, отфильтровываю через
пропускную бумагу образовавшийся черный осадок и тотчас, пока порошок
еще не просох, беру от фильтра с осадком небольшую часть. С нас ее будет
вполне достаточно; остальное выбрасываю в ведро с водою, куда я сливаю
ненужные растворы, остающиеся после наших опытов.
Попутно замечу, что выливать их потом надо
куда-нибудь подальше, где бы ими не могли отравиться домашние животное
или птицы, но отнюдь не в раковину водопровода, особенно если реакция их
кислая.
Кусочек еще влажной бумаги, покрытый черным
порошком, кладу в уголок на полу. Не подходите к нему близко и не
подпускайте к нему кошки или собаки.
Подождав, пока порошок просохнет, издали гусиным пером, привязанным к длинной палке или половой щетке, слегка прикасаюсь к нему.
Кто бы подумал, что взрыв будет так силен! Обратите внимание на фиолетовый пар, поднявшийся на месте взрыва.
Да, взрыв сильный! Это было одно из
сильнейших взрывчатых соединений азота - йодистый азот. Надо заметить,
что азот, такой невинный, такой индиферентный в свободном состоянии газ,
входит во все взрывчатые вещества. Вернее сказать, свойство таких
веществ моментально разлагаться на простейшие соединения зависит именно
от присутствия в них азота. Он не "любит" вступать в соединения с
другими веществами и при первой возможности их покидает. Мы знаем, что
он не поддерживает дыхания, - оттого-то ему и дали кличку "азот"
(то-есть безжизненный). Но как она ошибочна! Как раз наоборот: нет жизни
без азота. Органические вещества могут и не содержать его, но в
организмах он обязательно находится. Потому-то белковые тела иначе и
называются азотистыми. Их больше в организмах животных, чем в организмах
растений (за исключением грибов), но без тех немыслимо существование и
тех и других.
Что касается фиолетовых паров, на которые я
обратил ваше внимание, это - газообразный йод. Если вам удастся достать
в аптекарском магазине йод не в виде обычной тинктуры, то-есть
спиртного раствора, а в форме кристаллических сероватых чешуек слабо
металлического блеска, положите несколько таких кристалликов в
тонкостенную колбу, закрытую пробкой, и слегка подогрейте в пламени
спиртовой лампы. Нагревайте осторожно (рис. 41), вращая колбу, чтобы все
дно ее нагревалось равномерно. Колба наполнится газообразным йодом
великолепного фиолетового цвета (отсюда и название этого элемента: "йод"
значит - фиолетовый). На холодных стенках горда колбы и на основании
пробки он осядет мельчайшими блестящими кристалликами. Опыт можно
повторять сколько угодно раз.
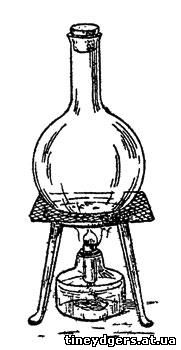
Рис 41. Получение газообразного йода
Спрячьте куда-нибудь колбу; при случае
удивите этим фокусом своих друзей. Только для того, чтобы помнить, что
колба не пустая, наклейте на нее билетик с надписью: "йод".
| 
