Много лет тому назад один известный ученый
писал другому: "Опишу вам опыт страшный и ужасный...", - а речь-то шла
всего-навсего о разряде лейденской банки, опыты с которой теперь
безбоязненно проделывает любой школьник.
Однако, ученый был прав, называя опыт
"ужасным", так как он иной раз оканчивался смертью экспериментатора
(например, смерть Доппельмейера в 1750 г.).
Отчего же то, что казалось раньше страшным, да и в самом деле таким было, теперь никого не пугает?
Оттого, что люди научились как следует обращаться с лейденской банкой, чтобы ее разрядом не причинять вреда ни себе, ни другим.
Химику подчас приходится иметь дело с веществами куда опаснее лейденской банки.
Даже при самом поверхностном знакомстве с
этой благодетельной, но и грозной наукой нельзя избежать встречи с
веществами, могущими оказаться очень опасными при неумелом обращении с
ними.
Немало химиков поплатились здоровьем и даже жизнью, впервые работая с такими веществами.
Зато теперь мы знаем, как обезопасить те
страшные силы, которые в них скрыты, и безбоязненно проделываем с ними
всевозможные опыты.
"Нет плохих ролей, а есть плохие актеры", -
уверял какой-то драматург. Так и мы скажем, что "нет опасных веществ, а
есть неумелые экспериментаторы",
Мы постараемся не попасть в их число. Хотя и
говорят: "Тот не ездок, кто под конем не бывал; тот не химик, у кого ни
разу водород не взорвало", - с последним я не согласен. Химик должен
быть осторожен и аккуратен, а у осторожного и аккуратного человека
никаких непредвидимых "случаев" быть не должно.
А потому, приняв все меры предосторожности, займемся теперь получением "страшных газов".
Кто не слышал об убийственных газах на
полях сражений последней мировой войны? Кто не читал предсказаний, что
последующие войны станут "химическими", что в них главная роль отведется
отравлению противника смертоносными, всюду проникающими ядами?
На первый раз мы познакомимся с газом, хотя
и не ядовитым и не применяемым в химической войне, но, тем не менее,
весьма опасным и требующим наибольшей осторожности при его получении.
Самый легкий газ
Самый легкий из всех газов называется водородом. Он в 14 раз легче воздуха. Воздух же, надо заметить, в 770 раз легче воды.
Таким образом, вода, с которой мы все так
хорошо знакомы, заключает в своем составе наиболее легкое из всех
известных нам на земле веществ.
А что это так, что вода не простое тело и водороду недаром дано его прозвище, я сейчас вам докажу.
Мы все безбоязненно пьем воду, она необходима для поддержания нашей жизни, она в количестве 58% входит в состав нашего тела.
Дело в том, что водород не растворен в
воде, как сахар в стакане чая: он вместе с другим газом, кислородом,
образует воду. В том-то и заключается удивительная тайна химических
превращений, что вещества, вступая в соединения друг с другом, дают
совершенно новые тела, а не простую смесь начальных веществ. Водород и
кислород - газы. Смешиваясь, они дают смесь газов; соединяясь, - воду.
Перейдем к некоторым опытам.
Перед вами две двугорлые склянки,
наполненные каждая на две трети водой; их горла плотно заткнуты
проваренными в парафине мягкими и упругими пробками; через первую пробку
первой склянки пропущена почти до самого дна склянки стеклянная трубка,
оканчивающаяся воронкой. Вторая пробка этой склянки соединена с первой
пробкой второй склянки изогнутой под прямыми углами стеклянной трубкой,
которая в первой склянке опущена лишь немногим ниже пробки, а во второй
доходит почти до дна. Из последней пробки выходит газоотводная трубка,
изогнутая, как показано на рис. 12. Оттянутый кончик ее с узким
отверстием погружен в воду пневматической ванны. Роль последней может
играть обыкновенная глубокая тарелка.
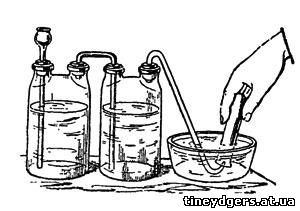
Рис. 12. Добывание водорода
Раньше чем приступить к опыту, я самым
тщательным образом замазываю все пробки (кроме первой) замазкой, чтобы
газ, который мы станем добывать, не нашел нигде выхода через зазоры
между стеклом и пробкой.
Наполнив два-три узких и высоких стеклянных
цилиндра водой, я прикрываю их квадратными кусочками матового стекла.
Цилиндры, при нужде, можно заменить обыкновенными
бутылками из-под минеральной воды или
из-под кваса, - словом, достаточно толстостенными. Здесь же на столе у
меня штатив с пробирками и полотенце; как можно дальше от прибора для
добычи газа, всего лучше - на особом столике, поставленном нескольких
шагах от первого, - спиртовая лампочка с колпаком (рис. 13).

Рис. 13. Спиртовая лампочка
В школах обычно добывают водород в подобных
приборах, действуя серной кислотой на цинк. Вы, вероятно, знаете, что
серную кислоту наливают в стаканчики, которые на зиму ставят между
двойными рамами окон. Она в высшей степени гигроскопична, т. е. отлично
сушит воздух, отнимая от него влагу; оттого-то в этом случае окна и не
"потеют". Обратите внимание, что с осени ее наливают не более четверти
стакана, а к весне стаканчики почти полны.
Металлы в большинстве случаев хорошо
растворяются в серной кислоте, образуя соответствующие сернокислые соли и
вытесняя из кислоты водород.
Применяемый для наполнения аэростатов
водород долгое время добывали подобным образом; только вместо дорогого
цинка брали дешевое железо в виде железного лома.
Однако, я покажу вам другой способ получения интересующего нас газа. Он гораздо удобнее и менее опасен.
Не будем забывать, что серная кислота - это
вещество, с которым, чем меньше будем иметь дела, тем лучше, особенно
когда нельзя обойтись каплей-другой, а приходится манипулировать с
относительно большими количествами ее.
Я воспользуюсь тем, что многие металлы
вытесняют водород не только из кислот, но и из воды. Правда, в
большинстве случаев такое разложение происходит лишь при очень высокой
температуре, но, по счастью, есть некоторые металлы, способные разлагать
воду и при обыкновенной температуре.
К таким металлам принадлежит кальций. Я
храню его в баночке с плотно притертой пробкой. Как видите, он залит
какой-то жидкостью. Это - керосин, на который кальций не действует
химически. Зато на воздухе этот металл быстро окисляется, ржавеет,
превращается в известь (негашеную). Тот же процесс происходит под водою,
только в этом случае образовавшаяся окись соединяется с избытком воды в
водную окись кальция (так называемую гашеную известь).
Вынув кусочек серовато-белого металла
щипчиками, осторожно обсушиваю его пропускной бумагой, удаляя следы
керосина, не касаясь металла руками.

Рис. 14. Неосторожный опыт с водородом
Теперь смотрите: я вынимаю из первой
склянки первую пробку, быстро бросаю куски кальция в воду, сейчас же
вновь закупориваю банку и обмазываю пробку замазкой.
Куски металла, упав на дно склянки,
покрываются пузырьками газа, которые, оторвавшись от поверхности кусков,
быстро всплывают вверх. Вскоре жидкость в банке кажется словно кипящей.
Выделяющийся газ вытесняет, вернее - увлекает с собой воздух и идет с
ним вместе во вторую склянку, а оттуда из газоотводной трубки - в
окружающую атмосферу, булькая пузырьками через воду.
Наполнив одну из пробирок водой, закрываю
ее большим пальцем, переворачиваю и опускаю ее конец в воду тарелки,
играющей у нас роль пневматической ванны. Отвожу палец в сторону и держу
отверстие пробирки над отверстием трубки. Пузырьки газа, ранее
выходившие через воду, идут в пробирку, вытесняя из нее воду. Вскоре
пробирка наполняется газом. Опять закрываю ее пальцем, вынимаю из воды и
быстро несу к столику, на котором стоит спиртовая лампочка. Держа
пробирку отверстием вниз, подношу ее к пламени и открываю.
Слышали свист? Он показывает, что водород в пробирке смешан с воздухом и обращаться с ним надо осторожно.
Нужно, следовательно, подождать немного,
пока выделяющийся водород вытеснит следы воздуха из аппарата. А чтобы не
сидеть без дела, прочтите страничку из книги одного английского химика о
том, как иногда может быть опасен взрыв водорода.
Вот что он пишет:
"Несколько лет тому назад рабочие, занятые
при постройке большого парового котла для германского военного судна, по
небрежности оставили внутри его несколько кусков цинка; им в голову не
приходило, что этим они могут причинить смерть многим своим товарищам и
повергнуть много рабочих семей в глубокое отчаяние. Паровик был поднят
на судно и установлен на место. Несколько времени спустя, судно
отправилось в пробное плавание. Трюм был переполнен занятыми кочегарами;
машины впервые дрогнули и быстро погнали мощное судно по морю. Вода за
это время нагрелась до чрезвычайно высокой температуры, и цинк быстро
растворялся в ней, освобождая при этом значительное количество
водородного газа. Этот газ вместе с воздухом образовал в паровике
страшно взрывчатую смесь. Люди, работавшие вокруг паровика, конечно,
ничего этого не подозревали, а между тем котел постепенно наполнялся все
больше и больше этой смертельной смесью. Как вдруг, без малейших
предупредительных признаков, с ослепительным блеском и оглушительным
громом большой паровик разорвался на части, убив или искалечив всех
находившихся в помещении людей, а само судно наполнилось облаком
перегретого пара. Причина взрыва осталась тайной, пока в остатках
паровика не нашли кусочков цинка.
Таким образом, мы видим, что силы
химического сродства, находясь под контролем, становятся полезными
слугами, а вне контроля - страшными господами".
Замазка Менделеева
Я сказал, что при сборке аппаратов для
получения газов следует все щели замазывать замазкой. Лучше всего брать
замазку, изобретенную нашим великим химиком Д. И. Менделеевым. Она
готовится сплавлением 100 частей канифоли с 25 частями воска, в которые
примешивается 40 частей железной муммии (красного окисла железа). К
расплавленному воску присыпают перемешивая, порошок канифоли, затем
муммии, продолжая нагревать и перемешивать, пока не получится однородная
масса, в которую и вливают масло, массу разливают в картонные формочки
или спичечные коробки. Перед применением ее вновь расплавляют. Замазка
склеивает стекло со стеклом и стекло с металлом.
Сам изобретатель был настолько доволен ею,
что не раз говаривал: "Эх, Дмитрий Иванович, чтобы ты делал, если бы
профессор Менделеев не изобрел своей замазки".
Кстати о Менделееве. Его научная
деятельность высоко ценилась в культурных странах, он был членом чуть ли
не всех европейских академий наук, кроме... русской.
Представители "чистой науки", петербургские
академики, забаллотировали его кандидатуру в члены Академии на том
основании, что он "унижает" себя, занимаясь чисто практическими
вопросами - приложением науки к технике.
Вода из огня
Ну, теперь опять можно вернуться к нашему
прибору. Наполним газом еще один цилиндр; на этот раз газ сгорает почти
беззвучно и не моментально; можно даже заметить появившееся при этом
почти бесцветное пламя.
Вынем газоотводную трубку из пневматической
ванны и, отвернув на всякий случай в сторону лицо, зажжем выходящий из
нее газ. Он горит спокойно (рис. 15), маленьким, еле видным пламенем.

Рис. 15. Сухой утюг покрывается каплями воды
Что же получается при горении? Вода! Приблизьте к пламени холодный, совершенно сухой утюг, - он покроется каплями воды.
Металлы отнимают от воды кислород, а выделившийся водород снова при сгорании соединяется с ним и снова превращается в воду.
Водород горит не только в воздухе: еще
энергичнее, чем с кислородом, соединяется этот газ с хлором. Если бы
опустить наше водородное пламя в сосуд с хлором, оно не погасло бы; оно
продолжало бы гореть, сменив свой голубоватый чуть заметный цвет на
зеленоватый, ясно видный. Хлор (мы еще с ним познакомимся) - цветной
газ. Его желто-зеленый цвет бледнел бы по мере горения водорода, и,
когда бы содержимое сосуда обесцветилось, пламя угасло бы само собою. В
результате горения мы получили бы уже знакомый нам по прежним опытам
хлористый водород.
Прилив в сосуд воды и взболтав сосуд, мы получили бы соляную кислоту, окрашивающую синюю лакмусовую бумажку в красный цвет.
Но мы не станем проделывать этот опыт: как хлор, так и хлористый водород ядовиты, и их не следует добывать в комнате.
"Взрыв" аэростата
Только в самые последние годы химики
обезопасили от огня воздухоплавание, наполняя оболочку дирижаблей
негорючим редким газом - гелием. К сожалению, гелий не так легок, как
водород, и, что самое важное, не всюду находится. Поэтому нельзя считать
проблему безопасности воздухоплавания уже решенной полностью.
Дирижабли, а тем более неуправляемые аэростаты, все еще наполняются в
большинстве случаев водородом, последние раньше наполнялись и светильным
газом. Светильный газ тяжелее водорода и также огнеопасен, но обходился
значительно дешевле. Сейчас это его преимущество отпало.

Рис. 16. Взрыв игрушечного аэростата
На улицах наших городов появляются часто
продавцы с гроздьями красных, зеленых и синих детских воздушных шаров,
наполненных светильным газом.
Купите при случае такой шар: с ним можно в
безопасном виде воспроизвести катастрофу, которая в действительности
ужасна. Такие катастрофы с воздухоплавателями, увы, бывали.
Прикрепив к шару легонькую корзиночку
(гондолу), вырезанную из бумаги, и усадив в нее таких же бумажных
воздухоплавателей, привяжите к нему вместо обычной тонкой бечевки,
удерживающей шар, стопиновую нить. Такие шары имеют внизу коротенькую
резиновую трубку, туго-натуго перевязанную несколькими оборотами
бечевки. Не развязывая последней, обвяжите трубочку концом стопиновой
нити. Стопин - это, собственно, не нить, а узенькая ленточка,
пропитанная медленно горящей смесью селитры с пороховой пылью. Метр
стопина сгорает в течение пятнадцати секунд. Вам его понадобится не
более полутора метров. Дав шару подняться на длину стопиновой нити,
подожгите свободный конец последней и выпустите шар на волю. Конечно,
опыт делайте не в комнате, а на открытом воздухе и в тихую погоду.
Шар, плавно поднявшись ввысь, менее чем
через минуту взрывается, и несчастные "аэронавты", крутясь и
перевертываясь в воздухе, падают к вашим ногам.
Переливание... вверх
Всегда ли переливаемое вещество льется
сверху вниз? Мы так привыкли переливать жидкости, которые во много раз
тяжелее воздуха, что нам и в голову не приходит ставить подобный вопрос.
А между тем, подумав, вы сами легко сообразите, что нельзя из пробирки с
водородом перелить этот газ в другую пробирку тем же приемом, какой мы
применяем при переливании воды. В этом случае придется как раз обратно -
переливать из нижней пробирки в верхнюю.
Наполнив под водой одну из пробирок
водородом, берем другую "пустую", то-есть наполненную воздухом, и, держа
последнюю отверстием вниз, ставим ее рядом с первой. Теперь пробирку с
водородом быстро перевертываем вверх отверстием так, чтобы оно пришлось
как раз под отверстием второй пробирки (рис. 17). Если опыт удался,
легонькая вспышка при приближении второй пробирки к пламени спиртовой
лампы докажет нам, что водород "перелился" в нее из первой пробирки.
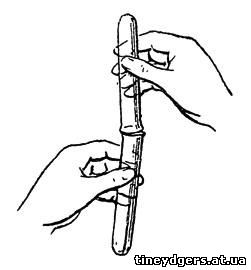
Рис. 17. Переливание вверх
Известный навык, требующийся для такого опыта, приобретается после двух-трех упражнений.
Мыльные пузыри
Обратили ли вы внимание, что мыльные пузыри
зимой поднимаются вверх, а летом падают вниз? Это происходит оттого,
что теплый воздух легче холодного и зимой разница между температурой
воздуха в комнате (особенно вблизи окон) и выдыхаемого вами в пузырь
достаточна, чтобы преодолеть тяжесть его оболочки. Наполняя мыльные
пузыри водородом, можно увидеть их летящими ввысь и в самый жаркий
летний день. Как бы тепел и легок ни был летний воздух, он все же
тяжелее водорода.
Чтобы получить пузыри величиной в крупное
антоновское яблоко, возьмите совершенно чистое, так называемое
марсельское мыло, настрогайте его перочинным ножом мелкими стружками и
растворите в воде, добавив потом к ней глицерина.
Мыла и глицерина возьмите поровну
(например, по 5 граммов), а дистиллированной или мягкой дождевой воды
вчетверо больше (20 граммов). Всыпав мыло в пузырек и залив водою,
оставьте стоять на сутки, потом долейте глицерином и, хорошо переболтав,
дайте смеси постоять еще сутки. Такая смесь будет вам служить долго;
для опытов же ее достаточно брать каждый раз по чайной ложке.

Рис. 18. Взрыв мыльного пузыря
Укрепив в отверстии газоотводной трубки
прибора для добывания водорода соломинку с расщепленными концами, легко
научиться при ее помощи выдувать крупные пузыри. Надо только несколько
изменить газоотводную трубку, надев на ее конец отрезок резиновой, а в
другой конец последней вставив стеклянную трубку с оттянутым концом.
Сжимая резиновую трубку пальцами, можно регулировать быстроту выдувания.
Пузыри поднимаются в комнате до самого
потолка, а на открытом воздухе в безветренную погоду улетают так высоко
(метров на двести), что скрываются из глаз.
Можете привязанным к палке горящим огарком
подорвать в полете и такой "мыльный аэростат". Только не забывайте о
близости прибора для получения водорода!
Налив мыльную воду в глубокую тарелку, и
погрузив в нее конец газоотводной трубки, получите целую гору мыльной
пены. Если отнести тарелку подальше от прибора с водородом, можно
взорвать пену.
Загадочный фонтан
"Ого, какое сложное сооружение!" Согласен,
сооружение внушительное, но не такое уж сложное, как кажется. Длинной
резиновой трубкой я соединяю наш аппарат для получения водорода с горлом
бутылки, дно у которой отрезано. Образовавшимся стеклянным цилиндром
прикрыт пористый глиняный сосуд от гальванического элемента,
поставленный дном вверх на круглую стеклянную пластинку с отверстием в
центре (рис. 19). Длинная стеклянная трубка, состоящая из двух отдельных
отрезков, соединенных резиновой трубочкой, выходит верхним концом в
пористый сосуд, а нижним пропущена через пробку двугорлой банки. Все это
устройство поддерживается металлической штангой с зажимом.
Склянка налита водой; из ее второго горла
выступает стеклянная трубка с оттянутым концом; нижний конец ее опущен
почти до дна склянки. Все щели и зазоры соединений плотно замазаны
замазкой.

Рис. 19. Фонтан
Пока я объяснял вам устройство прибора, я
все время сжимал пальцами резиновую трубочку, соединяющую длинные
вертикальные стеклянные трубки.
Отойдите подальше, чтобы вас не облило
водою; я опускаю руку, и... каков фонтан! Он бьет из узкого отверстия
левой трубки на высоту чуть ли не целого метра.
Зажав вновь резиновую трубочку, я останавливаю фонтан; отпустив опять, даю ему бить.
Не будем, впрочем, увлекаться этим зрелищем
и прекратим получение водорода; он в данном случае выходит прямо на
воздух, а вы знаете, как опасна такая смесь. Откроем окно, чтобы
очистить в комнате воздух, и разберем прибор на части.
Этот опыт основан на диффузии
(проникновении) водорода через пористые стенки глиняного сосуда. Оттуда
газ проходит в двугорлую склянку и давит на воду, заставляя ее бить
высоким фонтаном.
Из желтого в зеленое без прибавления синего
Раз уже у нас идет речь о водороде и под
руками имеется кальций, покажу вам еще один опыт. Он не особенно
эффектен, но поучителен.
В стакане - красно-желтый раствор хлорного
железа. Как превратить его цвет в зеленый, не приливая к нему синей
краски? Бросаем в стакан кусочек кальция; выделяется водород, и жидкость
постепенно зеленеет.
Это очень важная в химии реакция
восстановления, противоположная реакции окисления. Не будем пока на ней
останавливаться, но в дальнейшем я еще напомню вам об этом опыте. Он
поможет нам отчасти выяснить тайну строения окружающих нас веществ.
Последний перманентный газ
Шестьдесят лет тому назад газы делились на
перманентные (постоянные) и сгущаемые в жидкость. Одним из перманентных
был и водород. В 1877 г. Кальете и Пикте доказали, что всякий газ должен
сгуститься в жидкость, лишь бы удалось охладить его ниже его
"критической" температуры, при которой и выше которой он никаким
давлением сгущен быть не может. Вслед за ними Врублевский и Ольшевский
доказали это положение, обратив в жидкости кислород, азот и окись
углерода, а Дюар, сгустив водород.
Но вот в 1895 г. был открыт новый газ -
гелий, неизвестный во времена Дюара. Как ни велики были достижения
Дюара, давшие возможность получать твердую углекислоту ("сухой лед") и
кислород из воздуха, путем удаления из жидкого воздуха азота выкипанием
при несколько высшей температуре, гелий долгие годы никому не удавалось
сгустить.
Неужели были правы ученые прежних лет? Неужели гелий действительно перманентный газ? Даже при -268 Ц он оставался газом.
Чуть не 30 лет гелий истощал терпение
ученых, не желая подчиниться общему для всех газов закону. Только в 1922
г. удалось, наконец, Камерлингу Онесу, доведшему понижение температуры
до -268,8 Ц сгустить этот "последний перманентный газ". Кезанг при
-271,9 заморозил гелий в твердое, абсолютно прозрачное тело. Это
произошло 10 лет тому назад, в 1926 г. Камерлингу Онесу не удалось
дожить до этого дня, он умер несколькими месяцами раньше.
О гелии, об интересном пути его открытия,
нам еще придется сказать в дальнейшем. Это легчайший из газов, за
исключением водорода, и идет он на наполнение дирижаблей, так как он не
горюч и не взрывает в смеси с воздухом. Им же наполняют газосвечные
лампы, сигнализирующие сквозь туман. При прохождении через гелий тока,
он светит красным светом.
| 
