8 класс
1. Исходя из приведенного атомного
состава каолина, можно предположить, что в него
входят следующие оксиды: SiO2, Al2O3,
H2O. Если учесть индексы, стоящие при атомах
химических элементов в брутто-формуле каолина,
можно сделать вывод о мольных соотношениях
указанных оксидов. Формула каолина будет иметь
вид: 2SiO2•Al2O3•2H2O.
2.
Дано:
m1(S) = 4 г,
m
1(Al) – избыток,
m2(
Al) = 4 г,
m2(S) – избыток.
Найти:
m1(Al2S3),
m2(Al2S3)
Решение

4/96 = x1/150, x1 = 6,25 г;
4/54 = х2/150, х2 = 11,11 г.
Ответ. m(Al2S3),
полученного из 4 г алюминия, больше, чем из 4 г
серы.
3.
Дано:
(NH4)2Cr2O7,
Cr2(SO4)3.
Найти:
 1(Cr), 1(Cr),
 2(Cr).
2(Cr).
Решение
1) Mr((NH4)2Cr2O7) = 252,
Аr(Cr) = 52,
 1(Cr) = 2Аr(Cr)/Mr((NH4)2Cr2O7)•100(%)
= 104/252•100(%) = 41,27%. 1(Cr) = 2Аr(Cr)/Mr((NH4)2Cr2O7)•100(%)
= 104/252•100(%) = 41,27%.
2) Mr(Cr2(SO4)3) = 392, Аr(Cr)
= 52,
 2(Cr) = 2Аr(Cr)/Mr(Cr2(SO4)3)•100(%)
= 104/392•100(%) = 26,5%. 2(Cr) = 2Аr(Cr)/Mr(Cr2(SO4)3)•100(%)
= 104/392•100(%) = 26,5%.
Ответ. В соединении (NH4)2Cr2O7
содержание хрома выше.
4.
Дано:
m(HCl) = 20 г,
m
(Mg) = 1 г,
m
(Zn) = 1 г.
Найти:
как изменится равновесие.
Решение
Поскольку кислота дана в избытке, расчет ведем
по веществам, взятым в недостатке, – по металлам.

1/65 = х2/22,4, х2 = 0,34 л.
Ответ. В случае с магнием
выделится больший объем водорода, следовательно,
эта чаша потеряет в весе больше. Чаша с магнием
окажется выше.
5.
4NH3 + 3O2 = 2N2 + 6H2O,
2K + 2H2O = 2KOH + H2 , ,
(NH4)2Cr2O7 = N2 + 4H2O + Cr2O3, + 4H2O + Cr2O3,
P2O5 + 3H2O = 2H3PO4.
9 класс
1.
Дано:
V1(р-ра KOH) = 500 мл,
 1(КОН) = 10%,
1(КОН) = 10%,
 1(р-ра КОН) = 1,11
г/мл,
1(р-ра КОН) = 1,11
г/мл,
V
2(р-ра HCl) = 800 мл,
 2(HCl) = 20%,
2(HCl) = 20%,
 2(р-ра HCl) = 1,18
г/мл.
2(р-ра HCl) = 1,18
г/мл.
Найти:
концентрации всех веществ после реакции.
Решение
Найдем массу раствора КОН:
m(р-ра КОН) =  1•V1
= 1,11•500 = 555 г. 1•V1
= 1,11•500 = 555 г.
Найдем массу безводного КОН в растворе:
m(КОН) = 555•10/100 = 55,5 г.
Масса раствора соляной кислоты:
m(р-ра HCl) =  •V2 = 1,18•800 = 944 г. •V2 = 1,18•800 = 944 г.
Масса безводной кислоты в растворе:
m(HCl) = 944•20/100 = 188,8 г.
Запишем уравнение реакции:

Найдем, какое из веществ, вступивших в реакцию,
дано в избытке, а какое в недостатке:
 (KOH) = m/M =
55,5/56 = 0,99 моль, (KOH) = m/M =
55,5/56 = 0,99 моль,
 (HCl) = m/M =
188,8/36,5 = 5,17 моль.
(HCl) = m/M =
188,8/36,5 = 5,17 моль.
Кислота HCl дана в избытке, расчет ведем по KOH:
55,5/56 = х/74,5, х = 73,8 г.
Масса кислоты, не вступившей в реакцию:
m(HCl) = 188,8 – 36,17 = 152,63 г.
Общая масса раствора:
m(р-ра) = 555 + 944 = 1499 г.
Найдем концентрацию каждого вещества в
растворе:
 (HCl) = 152,63/1499•100(%) =
10,2%, (HCl) = 152,63/1499•100(%) =
10,2%,
 (KCl)= 73,8/1499•100(%) = 4,9%.
(KCl)= 73,8/1499•100(%) = 4,9%.
Ответ.  (HCl) = 10,2%, (HCl) = 10,2%,  (KCl)
= 4,9%. (KCl)
= 4,9%.
2.
Дано:
m(HNO3) = 10 г,
m
(CaCO3) = 2 г,
m
(FeS) = 2 г.
Найти:
изменение положения весов в конце реакции.
Решение
Найдем массу углекислого газа, выделяющегося
при взаимодействии HNO3 и CaCO3.
Изменение положения весов будет обусловлено
лишь убылью газа.

Рассчитаем мольные количества реагентов и
найдем, какое из веществ, вступивших в реакцию,
дано в избытке, а какое – в недостатке:
 (CaCO3) = m/M
= 2/100 = 0,02 моль, (CaCO3) = m/M
= 2/100 = 0,02 моль,
 (HNO3) = m/M
= 10/63 = 0,16 моль.
(HNO3) = m/M
= 10/63 = 0,16 моль.
Кислота дана в избытке, расчет ведем по
веществу, взятому в недостатке, – по карбонату
кальция:
2/100 = х/44, х = 0,88 г.
Чтобы найти массу газа, выделяющегося при
взаимодействии HNO3 и FeS, запишем уравнение
реакции:

Примем за y массу сульфида железа(II) и
найдем, какое из веществ, вступивших в реакцию,
дано в избытке, а какое – в недостатке:
10/126 = y/88, y = 7 г.
Сульфид железа(II) взят в недостатке,
следовательно, расчет ведем по этому веществу:
2/88 = z/34, z = 0,77 г.
В первом случае масса выделяющегося газа (СО2)
больше, чем во втором случае (выделение H2S).
Поэтому чаша с карбонатом кальция по окончании
реакции с азотной кислотой окажется выше.
Ответ.
Чаша весов с добавленным
карбонатом кальция по окончании реакции будет
выше чаши с добавленным сульфидом железа(II).
3.
Дано:
m(Mg + Cu) = 4 г,
V
(H2) = 1,12 л,
m
(HCl) – избыток.
Найти:
 (Mg), (Mg),
 (Mg),
(Mg),
Решение
Медь с соляной кислотой реагировать не будет.
По объему выделившегося водорода найдем массу
магния в смеси:

х/24 = 1,12/22,4, х = 1,2 г;
m(Cu) = 4 – 1,2 = 2,8 г,
 (Cu) = 2,8/4•100(%) = 70%, (Cu) = 2,8/4•100(%) = 70%,
 (Mg) = 100 – 70 = 30%. (Mg) = 100 – 70 = 30%.
Ответ.  (Mg) = 30%, (Mg) = 30%,  (Cu)
= 70%. (Cu)
= 70%.
4.
Дано:
l(ребра куба) = 0,8 см,
 (K) = 0,96 г/см3,
(K) = 0,96 г/см3,
m
1(р-ра KOH) = 500 г,
 1(KOH) = 10%.
1(KOH) = 10%.
Найти:
 2(KOH). 2(KOH).
Решение
m(KOH безводн.) = 500•10/100 = 50 г.
V(калиевого кубика) = l3 = 0,83 =
0,512 см3,
m(К) = V• =
0,512•0,96 = 0,49 г. =
0,512•0,96 = 0,49 г.

0,49/78 = х/112, х = 0,7 г (mнов (KOH)).
0,49/78 = y/2, y = 0,013 г.
m(р-ра) = m1(р-ра KOH) + m(K) – m(H2)
= 500 + 0,49 – 0,013  500,48 г, 500,48 г,
 2(KOH) = [m(KOH
безводн.) + mнов(KOH)]/m(р-ра)• 100(%) =
50,7/500,48•100(%) = 10,13%. 2(KOH) = [m(KOH
безводн.) + mнов(KOH)]/m(р-ра)• 100(%) =
50,7/500,48•100(%) = 10,13%.
Ответ.  (KOH) = 10,13%. (KOH) = 10,13%.
5.
P + HNO3 (конц.) 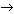 H3PO4
+ NO. H3PO4
+ NO.
Электронный баланс:

3P + 5HNO3 (конц.) 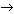 3H3PO4
+ 5NO. 3H3PO4
+ 5NO.
Для уравнивания числа атомов Н и О в левую часть
уравнения необходимо добавить две молекулы воды:
3P + 5HNO3 + 2Н2О = 3H3PO4
+ 5NO . .
HNO3 (конц.) + S 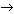 NO2 + H2SO4 + H2O. NO2 + H2SO4 + H2O.
Электронный баланс:

6HNO3 (конц.) + S = 6NO2 + H2SO4 + 2H2O. + H2SO4 + 2H2O.
6. Безусловно, слив растворы хлорида
железа(III) и карбоната натрия, юный химик не смог
бы получить карбонат железа(III). Дело в том, что
хлорид железа(III) образован катионом слабого
основания – Fe(OH)3 – и анионом сильной
соляной кислоты. В растворе эта соль будет
подвергаться гидролизу с образованием кислой
среды. Карбонат натрия также будет подвергаться
гидролизу. Он образован катионом сильного
основания – NaОН – и анионом слабой угольной
кислоты. Карбонат железа(III) образован анионом
слабой кислоты – угольной – и катионом слабого
основания – Fe(OH)3. Cоль Fe2(CO3)3
подвергается гидролизу, причем гидролиз будет
протекать до конца:
2FeCl3 + 3Na2CO3 + 3H2O =
2Fe(OH)3 + 6NaCl +
3CO2 + 6NaCl +
3CO2 . .
Гидроксид железа(III) Fe(OH)3 – осадок
коричневого цвета. Карбонат железа (III) в растворе
не существует.
| 
