Среди нетрадиционных форм,
используемых при преподавании химии в 8-м классе,
дидактические игры наиболее популярны. С одной
стороны, это обусловлено психологическими
особенностями подростков, с другой –
программными требованиями по предмету.
Использование дидактических игр на уроках
контроля знаний и умений вызывает интерес и
положительные эмоции, способствует
предупреждению перегрузки, снимает чувство
беспокойства.
Представленные игры можно использовать как
командные, способствующие развитию
организационных и коммуникативных умений
восьмиклассников, так и индивидуальные, служащие
для проверки, коррекции знаний конкретного
ученика.
«Построй фигуры»
Химический диктант проводят с
целью проверки знания химических знаков и их
изображения. Каждому ученику выдают лист бумаги
с беспорядочно расставленными точками, каждой из
которых соответствует знак химического элемента
(рис. 1, 2).
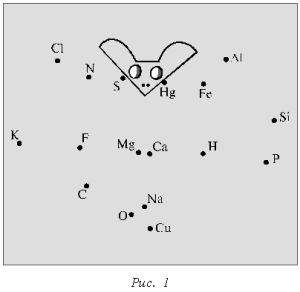 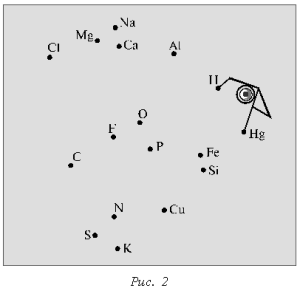
Учитель в определенной
последовательности называет химические
элементы (фосфор, калий, азот, сера, фтор,
кислород, магний, кальций, натрий, водород, ртуть,
железо, фосфор), а школьники соединяют знаки этих
элементов прямыми линиями в той же
последовательности.
В результате должны
получиться определенные фигуры (рис. 3, 4).
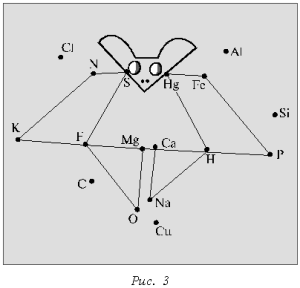 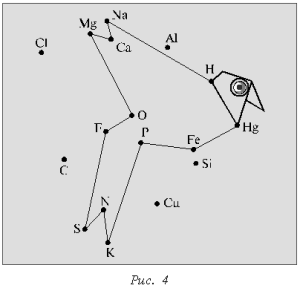
Для усложнения задачи на
листе нанесены химические символы элементов, не
входящих в диктант.
Такая форма химического
диктанта предполагает множество вариантов.
«Логические цепочки»
При изучении периодической
системы и строения атома можно использовать
задания в форме логических цепочек, в которых
некоторые звенья пропущены. Каждому ученику
выдают карточку с заданием.

Справа от задания ученики
записывают объяснения своих ответов.
При этом можно пользоваться
только периодической системой. Задания от а) до г)
постепенно усложняются.
Ответы:
а) Na ® Mg ® Al – элементы одного периода;
б) N ® P ® As ® Sb ® Bi – элементы V группы главной
подгруппы;
в) R2O ® RO ® R2O3 ® RO2 ® R2O5
® RO3
® R2O7
– формулы высших оксидов элементов главных
подгрупп I–VII групп периодической системы;
г) 1s1 ® 1s2 2s1
® 1s2
2s2 2p6 3s1 ® 1s2 2s2
2p6 3s2 3p6 4s1
– электронные формулы элементов I группы
главной подгруппы.
«Найди триаду»
Эту игру используют для
закрепления или проверки знаний о строении
атомов химических элементов и свойствах
образованных ими веществ. Игру можно проводить
как со всем классом (игровые поля изображают на
доске), так и индивидуально (игровые поля выдают
на карточках).
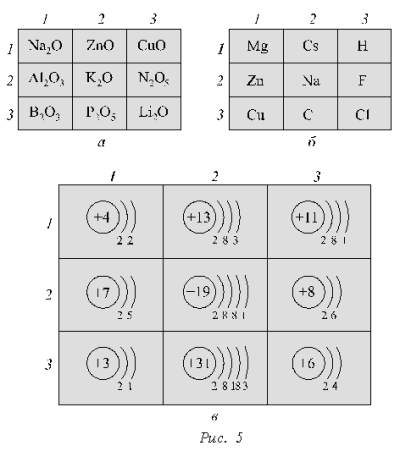
В трех квадратах (рис. 5),
изображающих игровые поля, находятся оксиды (а),
химические элементы (б), электронные формулы
атомов (в). Для выполнения каждого задания
необходимо указать связующий признак, согласно
которому можно соединить три клетки поля прямой
линией по вертикальному, горизонтальному рядам
или диагоналям. Предварительно учащимся
сообщается о наличии нескольких триад на каждом
поле.
Ответы:
а) 1-й ряд по горизонтали
(оксиды металлов), 1–3-й по диагонали (высшие
оксиды элементов I группы главной подгруппы);
б) 1-й ряд по горизонтали
(относятся к s-элементам), 1-й ряд по вертикали
(металлы), 3-й ряд по вертикали (неметаллы);
в) 1-й ряд по вертикали (атомы
всех элементов имеют по два электронных слоя),
3–3-й по диагонали (атомы всех элементов имеют по
одному электрону на внешнем уровне).
«Алфавит»
Игра состоит из трех этапов,
каждый из которых проверяет:
– умение учащихся определить
химический элемент по строению его атома;
– усвоение понятия «амфотерность»;
– умение получать в лаборатории амфотерные
гидроксиды и доказывать их свойства.
Для проведения игры на доске
записывают алфавит с указанием номеров букв:

Учитель зачитывает
характеристики химических элементов. Задача
учащихся – определить порядковый номер элемента
в периодической системе, которому соответствует
определенная буква в алфавите.
Например, относительную
атомную массу 20 имеет неон. Его порядковый номер
10, которому соответствует буква И.
Ответив на ряд вопросов,
ученики получают набор букв и составляют из них
название химического элемента.
Вопросы для
проведения игры
Вариант 1
1) Относительная атомная масса
элемента равна 20. (№ 10 Nе соответствует
букве И.)
2) Элемент 3-го периода II
группы. (№ 12 Мg соответствует букве К.)
3) Элемент V группы, в его атоме
три энергетических уровня. (№ 15 Р
соответствует букве Н.)
4) В ядре атома 24 протона. (№ 24
Сr соответствует букве Ц.)
Таким образом, получаем
следующий набор букв: И, К, Н, Ц.
Название элемента из этих букв – цинк.
Вариант 2
1) Относительная атомная масса
элемента 40. (№ 18 Аr соответствует букве Р.)
2) Электронная формула атома
химического элемента 1s2 2s2 2p6
3s2 3p2. (№ 14 Si
соответствует букве М.)
3) Химический элемент 3-го
периода образует высший оксид RO3 и летучее
водородное соединение H2R. (№ 16 S
соответствует букве О.)
4) Относительная атомная масса
элемента 51, число нейтронов в атоме 28. (№ 23 V
соответствует букве Х.)
Набор букв: Р, М, О, Х.
Название элемента из этих
букв – хром.
Вариант 3
1) Элемент 3-го периода III
группы. (№ 13 Аl соответствует букве Л.)
2) Элемент 2-го периода,
инертный газ. (№ 10 Nе соответствует букве И.)
3) Электронная формула
внешнего энергетического уровня атома
химического элемента 4s2 4p2.
(№ 32 Ge соответствует букве Ю.)
4) Элемент 3-го периода,
щелочной металл. (№ 11 Nа соответствует букве
Й.)
5) Xимический элемент, атом
которого имеет один электрон. (№ 1 Н
соответствует букве A.)
6) Электронная формула атома
химического элемента 1s2 2s2 2p6
3s2 3p3. (№ 15 P
соответствует букве H.)
7) Атом химического элемента
имеет 10 электронов. (№ 10 Nе соответствует
букве И.)
8) Химический элемент IV группы,
атом его соседа слева имеет 13 протонов. (№ 14 Si
соответствует букве M.)
Набор букв: Л, И, Ю, Й,
А, Н, И, М.
Название элемента из этих
букв – алюминий.
После того как все три
элемента отгаданы, учитель обращается к классу с
вопросом: «Какие свойства характерны для
алюминия, хрома, цинка и их оксидов и
гидроксидов?»
Для проверки усвоения понятия
«амфотерность» ученикам предлагают заполнить
пустые клетки в кроссвордах на доске (рис. 6).
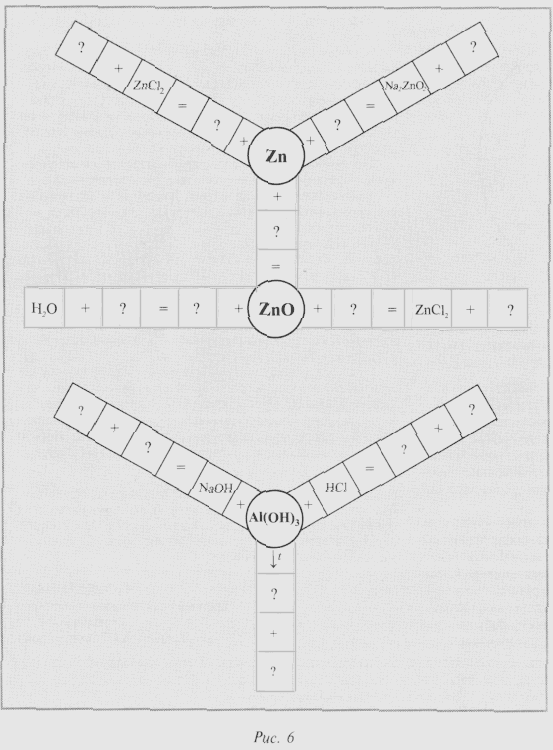
Проверив правильность
написания уравнений в кроссвордах, ученики
демонстрируют химические реакции, характерные
для гидроксидов цинка и алюминия, предварительно
получив их.
«Морской бой»
Обобщающий урок по теме
«Периодический закон и периодическая система
химических элементов Д.И.Менделеева» может быть
проведен в форме детской игры «Морской бой».
В игре участвуют две команды.
Число игроков в каждой команде должно совпадать
с числом вопросов. Каждой паре участников выдают
лист с вопросами тестового типа. Рядом с ответами
в скобках стоят соответствующие координаты
игрового поля. Если ответ выбран правильно, то
«корабль» «убит» или «ранен». Во избежание
случайного попадания в игре используют только
одно- и двухпалубные «корабли».
В процессе игры пары игроков
команд по очереди отвечают на вопросы. Игроки
зачитывают вопрос и выбирают правильный, по их
мнению, ответ. Независимо от правильности ответа
право хода предоставляется команде-противнику.
Обсуждение вопросов,
вызвавших затруднения, происходит по ходу игры.
За их разъяснением учитель обращается к классу.
Если никто из игроков команды, члены которой
допустили ошибку, не может ответить на вопрос, то
право ответа переходит к другой команде. За
правильное объяснение команда-противник
получает дополнительное очко. Для проведения
игры учитель заранее заготавливает на ватмане
два игровых поля (размером 10ґ10 клеток), записав по
горизонтали ряд букв: А, Б, В, Г, Д, Е, Ж, З, И, К, а
по вертикали – ряд цифр от 1 до 10.
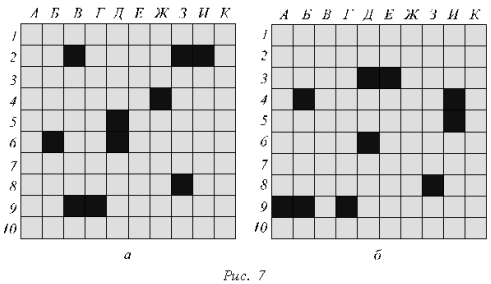
Капитан каждой команды
отмечает на соответствующих игровых полях
ответы своих игроков и соперников, сообщает
результаты «выстрелов» всему классу («ранен»,
«убит», «мимо»), регистрирует правильные ответы
своей команды.
Вопросы, для игры можно
разделить по содержанию на три группы:
периодический закон,
структура периодической системы;
электронное строение атомов
химических элементов;
зависимость свойств
химических элементов и их соединений от
положения в периодической системе.
Предлагаем следующие вопросы
для проведения этой игры.
· Вопросы первой команды
(ответы смотри на игровом поле второй команды,
рис. 7, б)
1. Современная формулировка
периодического закона:
«Свойства химических
элементов и их соединений находятся в
периодической зависимости от...»:
а) величины их атомной массы (Д-2);
б) числа нейтронов в атомном
ядре (К-3);
в) числа электронов в атоме (Б-3);
г) заряда ядра атома (Б-4).
2. Число электронных уровней
в атоме любого химического элемента можно
определить:
а) по номеру периода (Д-3);
б) по номеру группы (Д-4);
в) по номеру ряда (Д-2);
г) по порядковому номеру
элемента (Г-3).
3. Кислотным и основным
оксидами являются соответственно:
а) Na2О и СаО (Д-4); в) Р2O5
и СО2 (Г-3);
б) СuО и СrО3 (Д-2); г) SО3
и СаО (E-3).
4. С увеличением заряда ядра
у атомов химических элементов в периоде:
а) металлические свойства
усиливаются (Ж-2);
б) неметаллические свойства
усиливаются (И-4);
в) металлические свойства не
изменяются (К-3);
г) неметаллические свойства
не изменяются (В-1).
5. Электроотрицательность
имеет наибольшее значение у химических
элементов, расположенных:
а) в начале периода (З-4);
б) в середине периода (И-3);
в) в конце периода (И-5).
6. Электронная формула атома
натрия:
а) 1s2 2s2 2p6
3s2 (В-2); в) 1s2 2s2 (К-2);
б) 1s2 2s1 (А-1);
г) 1s2 2s2 2p6 3s1
(Д-6).
7. Конфигурацию внешнего
электронного уровня 3s2 3p2 имеет атом
элемента:
а) № 14 (Б-9); в) № 6 (Е-1);
б) № 12 (Ж-6); г) № 5 (Б-2).
8. Какие элементы образуют
высшие оксиды с общей формулой R2О3?
а) Мg, Са, Ве (Б-8); в) В, Аl, Ga (A-9);
б) N, Р, Аs (Б-10); г) С, Si, Gе (B-9).
9. Электронная формула атома
химического элемента 1s2 2s2 2p6
3s2 3p3. Формула высшего оксида
данного элемента:
а) Р2О3 (З-7); в) N2О5
(З-2);
б) Al2О3 (З-5); г) P2О5
(З-8).
10. Закончите уравнение
реакции, расставьте коэффициенты:
ZnO + NаОН ® ? + ?
Мольное соотношение веществ,
вступивших в реакцию, равно:
а) 1:1 (Г-8); в) 1:3 (Г-10);
б) 1:2 (Г-9); г) 2:1 (Д-9).
· Вопросы второй команды
(ответы смотри на игровом поле первой команды,
рис. 7, а)
1. В периодической системе в
состав побочных подгрупп входят элементы:
а) как малых, так и больших
периодов (Б-2);
б) только малых периодов (Г-3);
в) только больших периодов (В-2).
2. Число электронов на
внешнем уровне у атомов элементов главных
подгрупп можно определить:
а) по номеру периода (Д-1);
б) по номеру группы (Д-5);
в) по номеру ряда (К-2);
г) по порядковому номеру
элемента (И-3).
3. Какие вещества в паре
являются амфотерными гидроксидами:
а) Ва(ОН)2 и Сu(ОH)2 (Д-4);
б) Zn(ОH)2 и NаОH (Г-5);
в) Zn(ОH)2 и Аl(ОH)3 (Д-6);
г) Fe(ОH)2 и Fe(ОH)3 (E-5).
4. У элементов главных
подгрупп периодической системы с увеличением
заряда ядра:
а) неметаллические свойства
усиливаются (Б-5);
б) металлические свойства не
изменяются (Б-7);
в) неметаллические свойства
ослабевают (В-9);
г) неметаллические свойства
не изменяются (А-6).
5. Электронная формула атома
серы:
а) 1s2 2s1 (В-8);
в) 1s2 2s2 2p6 3s2
3p4 (Г-9);
б) 1s2 2s2 2p6
3s1 (Б-9); г) 1s2 2s2 2p6
3s2 3p5 (В-10).
6. Электроотрицательность
увеличивается в ряду элементов:
а) Сl, S, Р, Аl (Б-3); в) B, Аl, Ga, In (Б-9);
б) Li, С, N, F (Б-6); г) Li, Nа, К, Rb (A-7).
7. Атом какого элемента
имеет конфигурацию внешнего электронного уровня
3s2 3p1?
а) № 5 (Д-2); в) № 15 (А-8);
б) № 3 (К-8); г) № 13 (Ж-4).
8. Формула вещества,
образующегося при взаимодействии с водой
высшего оксида элемента № 6:
а) Э(ОН)4 (З-7); в) Н2ЭО3
(З-8);
б) Н4ЭО4 (З-9); г)
Н2Э (З-5).
9. Элементы образуют
газообразные водородные соединения с общей
формулой RН3 и высшие оксиды состава R2О5.
Какова электронная формула внешнего
энергетического уровня их атомов?
а) ns2 np3 (И-2);
в) ns2 np4 (З-9);
б) ns2 np5 (З-7);
г) np3 (Ж-8).
10. Закончите уравнение
реакции, расставьте коэффициенты:
Аl(ОН)3 + НСl ® ? + ?
Мольное cоотношение веществ,
вступивших в реакцию, равно:
а) 1:3 (З-2); в) 1:2 (И-3);
б) 1:1 (И-1); г) 2:1 (К-2).
* * *
Победителем становится
команда, набравшая за игру большее количество
очков.
| 
